题目内容
15.在100ml,0.1mol•L-1HA的溶液中,c(H+)=0.05mol•L-1,往该溶液中加入等体积浓度的NaOH溶液(忽略溶液混合体积变化),下列离子浓度关系正确的是( )| A. | c(Na+)>c(A-)>c(H+)>c(OH-) | B. | c(A-)+c(HA)=0.05mol•L-1 | ||
| C. | c(Na+)>c(A-)>c(HA)>c(OH-) | D. | c(HA)+c(H+)=c(A-)+c(OH-) |
分析 在100ml,0.1mol•L-1HA的溶液中,c(H+)=0.05mol•L-1,则酸HA为弱酸,加入等体积浓度的NaOH溶液,混合后生成NaA,NaA水解后溶质为NaA和HA,根据电荷守恒和物料守恒判断,NaA水解,c(Na+)>c(A-),电荷守恒有:c(Na+)+c(H+)=c(A-)+c(OH-),物料守恒有:c(Na+)=c(A-)+c(HA),据此分析解答.
解答 解:A.在100ml,0.1mol•L-1HA的溶液中,c(H+)=0.05mol•L-1,则酸HA为弱酸,加入等体积浓度的NaOH溶液,发生反应:HA+NaOH=NaA+H2O,NaA水解,存在A-+H2O?HA+OH-,则c(OH-)>c(H+),故A错误;
B.100ml,0.1mol•L-1HA的溶液和等体积浓度的NaOH溶液混合,所得溶液中c(Na+)=0.05mol/L,NaA水解,A-+H2O?HA+OH-,所得溶液中存在物料守恒为:c(Na+)=c(A-)+c(HA)=0.05mol/L,故B正确;
C.HA为弱酸,NaA水解,c(Na+)>c(A-),c(OH-)除了水解产生的还有水电离的,因此c(OH-)>c(HA),所以有:c(Na+)=0.05mol/L>c(A-)>c(OH-)>c(HA)>c(H+),故C错误;
D.0.1mol•L-1HA溶液与0.1mol•L-1NaOH溶液等体积混合后所得溶液中,由电荷守恒有:c(Na+)+c(H+)=c(A-)+c(OH-),由物料守恒有:c(Na+)=c(A-)+c(HA)②,将②代入①得:c(H+)+c(HA)=c(OH-),故D错误;
故选B.
点评 本题考查了酸碱混合溶液定性判断,根据酸的强弱结合物料守恒、电荷守恒分析解答,考查离子浓度大小比较、溶液PH值、盐类水解等,判断一元酸HA是弱酸为解题关键,题目难度中等.

 名校课堂系列答案
名校课堂系列答案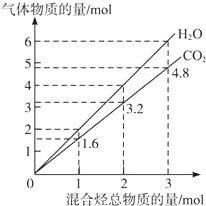 两种气态烃组成的混合气体完全燃烧后所生成CO2和H2O的物质的量随混合烃总物质的量的变化如图所示,则下列关于混合烃的判断正确的是( )
两种气态烃组成的混合气体完全燃烧后所生成CO2和H2O的物质的量随混合烃总物质的量的变化如图所示,则下列关于混合烃的判断正确的是( ) ①一定有乙烯 ②一定有甲烷 ③一定有丙烷 ④一定没有乙烷 ⑤可能有乙烷 ⑥可能有乙炔.
| A. | ②⑤⑥ | B. | ②⑥ | C. | ②④ | D. | ②③ |
| 实验 | 除杂试剂 | 实验目的 | |
| ① | 电石与水反应 | CuSO4溶液 | 用KMnO4酸性溶液检验乙炔的还原性 |
| ② | CH3CH2Br与NaOH溶液共热 | HNO3溶液 | 用AgNO3溶液检验CH3CH2Br中的Br |
| ③ | 淀粉与稀H2SO4水浴共热 | NaOH溶液 | 用新制氢氧化铜检验水解产物的还原性 |
| ④ | C2H5OH与浓H2SO4加热至170℃ | NaOH溶液 | 用Br2的CCl4溶液证明该反应为消去反应 |
| A. | 只有①②③ | B. | 只有①②④ | C. | 只有②③④ | D. | ①②③④ |
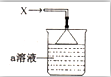 如图所示,烧杯中盛有的a溶液仅含三种离子,常温下PH=1,当它吸收一定量的易液化的气体X(纯净物)后,得到一种w溶液,W溶液无色透明,含有四种离子,其中一种离子含有18个电子,两种离子各含有10个电子,下列说法正确的是( )
如图所示,烧杯中盛有的a溶液仅含三种离子,常温下PH=1,当它吸收一定量的易液化的气体X(纯净物)后,得到一种w溶液,W溶液无色透明,含有四种离子,其中一种离子含有18个电子,两种离子各含有10个电子,下列说法正确的是( )| A. | 气体X易液化的原因是相对分子质量较大 | |
| B. | W溶液四种离子中两两结合所能形成的离子化合物有两种 | |
| C. | 若a溶液吸收一定量的气体X后,溶液pH=7,此时溶液中有4种溶质 | |
| D. | a溶液中由水电离出的c(H+)=10-13mol•L-1 |
②H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H2=-242kJ•mol-1
③2C2H2(g)+5O2(g)=4CO2(g)+2H2O(g)
④2C(s)+H2(g)=C2H2(g)△H4
下列正确的是( )
| A. | 反应①放出197kJ的热量,转移4mol电子 | |
| B. | 反应②可知1mol液态水分解所放出的热量为242kJ | |
| C. | 反应③表示C2H2燃烧热的热化学方程式 | |
| D. | △H4=2△H1+△H2-$\frac{1}{2}$△H3 |
| A. | 标准状况下11.2L乙烯和丙烯的混合气体中含C-H键的数目为2NA | |
| B. | S2和S8的混合物共6.4g,其中所含硫原子数一定为0.2NA | |
| C. | 0.5mol熔融的NaHSO4中含有的离子数目为1.5NA | |
| D. | 含0.2molH2SO4的浓硫酸与足量铜反应,生成SO2的分子数为0.1NA |
 .下列说法正确的是( )
.下列说法正确的是( )| A. | 聚乳酸的相对分子质量是72 | B. | 聚乳酸的分子式是C3H4O2 | ||
| C. | 乳酸的分子式是C3H6O2 | D. | 聚乳酸可以通过水解降解 |
