题目内容
17.准确称取0.86g不纯的苛性钠样品配成250mL溶液,取出10.0mL,用已知浓度为0.040mol•L-1的盐酸进行滴定(杂质不与盐酸反应).达到滴定终点时,共消耗盐酸20.5mL.(1)求该样品中苛性钠的质量分数
(2)若操作过程中未用盐酸润洗滴定管,对测试结果有何影响?
(3)待测液的锥形瓶是否需要润洗?为什么?
分析 (1)根据滴定原理计算氢氧化钠的质量,根据样品中苛性钠的质量分数=$\frac{氢氧化钠的质量}{样品的质量}$×100%;
(2)未用盐酸润洗滴定管,相当于用的盐酸的浓度偏小,所以消耗的盐酸的体积偏大;
(3)待测液的锥形瓶不需要润洗,有没有水都不会影响溶质的物质的量.
解答 解:(1)样品中氢氧化钠的质量m=0.0205L×0.040mol/L×25×40g/mol=0.82g,样品中苛性钠的质量分数=$\frac{氢氧化钠的质量}{样品的质量}$×100%=$\frac{0.82}{0.86}$×100%≈95.3%;
答:该样品中苛性钠的质量分数是95.3%;
(2)未用盐酸润洗滴定管,相当于用的盐酸的浓度偏小,所以消耗的盐酸的体积偏大,计算出的氢氧化钠质量偏高,样品中的含量偏高,答:使结果偏高;
(3)待测液的锥形瓶不需要润洗,锥形瓶是否干燥不影响待测液的溶质的物质的量,无需干燥,答:不需要;锥形瓶是否干燥不影响待测液的溶质的物质的量.
点评 本题考查学生滴定操作中仪器的使用以及实验误差分析知识,属于基本知识的考查,难度不大.

练习册系列答案
 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案
相关题目
7.已知H-H键能为436KJ/mol,H-N键能为391KJ/mol,根据化学方程式:N2( g )+3H2( g )=2NH3( g )1molN2完全消耗共放出能量为92.4kJ,则N≡N键的键能是( )
| A. | 431 KJ/mol | B. | 946 KJ/mol | C. | 649 KJ/mol | D. | 869 KJ/mol |
8.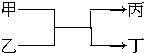 若甲、丙为短周期、同一主族元素形成的单质,乙、丁都是由两种元素组成的化合物,它们之间有如图所示的转化关系,则满足条件的甲和丙可以为( )
若甲、丙为短周期、同一主族元素形成的单质,乙、丁都是由两种元素组成的化合物,它们之间有如图所示的转化关系,则满足条件的甲和丙可以为( )
①钠和氢气 ②氟气和氧气 ③碳和硅 ④氯气和溴.
 若甲、丙为短周期、同一主族元素形成的单质,乙、丁都是由两种元素组成的化合物,它们之间有如图所示的转化关系,则满足条件的甲和丙可以为( )
若甲、丙为短周期、同一主族元素形成的单质,乙、丁都是由两种元素组成的化合物,它们之间有如图所示的转化关系,则满足条件的甲和丙可以为( )①钠和氢气 ②氟气和氧气 ③碳和硅 ④氯气和溴.
| A. | ①③ | B. | ①④ | C. | ②③ | D. | ②④ |
5.下列实验中,为实现实验目的而必须除杂的是( )
| 实验 | 除杂试剂 | 实验目的 | |
| ① | 电石与水反应 | CuSO4溶液 | 用KMnO4酸性溶液检验乙炔的还原性 |
| ② | CH3CH2Br与NaOH溶液共热 | HNO3溶液 | 用AgNO3溶液检验CH3CH2Br中的Br |
| ③ | 淀粉与稀H2SO4水浴共热 | NaOH溶液 | 用新制氢氧化铜检验水解产物的还原性 |
| ④ | C2H5OH与浓H2SO4加热至170℃ | NaOH溶液 | 用Br2的CCl4溶液证明该反应为消去反应 |
| A. | 只有①②③ | B. | 只有①②④ | C. | 只有②③④ | D. | ①②③④ |
12.用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 常温常压下,33.6L氯气与27g铝充分反应,转移电子数为3NA | |
| B. | 标准状况下,22.4L己烷中共价键数目为19NA | |
| C. | 通常状况下,2.24LNO2和N2O4的混合气体中氮原子和氧原子数比为1:2 | |
| D. | 1mol•L-1的Na2CO3溶液中所含阴离子数大于NA个 |
7.已知:①C(S)+O2=CO2(g)△H1=-394kJ•mol-1
②H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H2=-242kJ•mol-1
③2C2H2(g)+5O2(g)=4CO2(g)+2H2O(g)
④2C(s)+H2(g)=C2H2(g)△H4
下列正确的是( )
②H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H2=-242kJ•mol-1
③2C2H2(g)+5O2(g)=4CO2(g)+2H2O(g)
④2C(s)+H2(g)=C2H2(g)△H4
下列正确的是( )
| A. | 反应①放出197kJ的热量,转移4mol电子 | |
| B. | 反应②可知1mol液态水分解所放出的热量为242kJ | |
| C. | 反应③表示C2H2燃烧热的热化学方程式 | |
| D. | △H4=2△H1+△H2-$\frac{1}{2}$△H3 |
8.利用如图所示装置进行下列实验,能得出相应实验结论的是( )
| 选项 | ① | ② | ③ | 实验结论 | 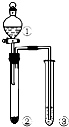 |
| A | NaCl溶液 | 电石 | 酸性KMnO4 | 乙炔具有还原性 | |
| B | 浓硝酸 | Na2CO3 | 苯酚钠溶液 | 酸性:硝酸>碳酸>苯酚 | |
| C | 浓盐酸 | KMnO4 | FeBr2(足量) | 氧化性:Cl2>Br2 | |
| D | 浓硫酸 | 蔗糖 | 溴水 | 浓硝酸具有脱水性、氧化性 |
| A. | A | B. | B | C. | C | D. | D |
