题目内容
20.短周期元素X、Y、Z在元素周期表中的位置如图,已知X与Y的原子序数之和等于Z的原子序数.下列说法错误的是( )| X | Y | |
| Z |
| A. | Y的气态氢化物比X的最简单气态氢化物的稳定性高 | |
| B. | 在X、Y、Z三种元素中,只有X的最高价氧化物对应的水化物与它的气态氢化物可以反应生成盐 | |
| C. | 由X、Y、Z分别形成的单质,常温下Z单质的沸点最高 | |
| D. | 在标准状况下,1molY 的氢化物的体积约为22.4L |
分析 X、Y、Z都是短周期元素,由元素在周期表中的位置可知,X、Y处于第二周期,Z处于第三周期,令x的原子序数为a,则Y原子序数为a+2、Z原子序数为a+9,由X、Y原子序数之和等于Z的原子序数,则a+a+2=a+9,解得a=7,则X为N、Y为F、Z为S,据此解答.
解答 解:X、Y、Z都是短周期元素,由元素在周期表中的位置可知,X、Y处于第二周期,Z处于第三周期,令x的原子序数为a,则Y原子序数为a+2、Z原子序数为a+9,由X、Y原子序数之和等于Z的原子序数,则a+a+2=a+9,解得a=7,则X为N、Y为F、Z为S,
A.同周期自左而右非金属性增强,故非金属性Y>Z,非金属性越强,氢化物越稳定,故氢化物稳定性Y>Z,故A正确;
B.非金属元素之间形成盐,则该盐为铵盐,所以只有N的最高价氧化物对应的水化物与它的气态氢化物可以反应生成盐,故B正确;
C.N、F的单质常温下均为气体,S的单质常温下为固体,则S单质的沸点最高,故C正确;
D.在标准状况下HF为液体,则在标准状况下,1molHF的体积约远小于22.4L,故D错误,
故选D.
点评 本题考查元素周期表与元素周期律,难度不大,根据同主族元素原子序数关系进行推断是关键,注意元素周期律的理解掌握.

练习册系列答案
相关题目
8.利用如图所示装置进行下列实验,能得出相应实验结论的是( )
| 选项 | ① | ② | ③ | 实验结论 | 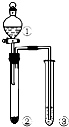 |
| A | NaCl溶液 | 电石 | 酸性KMnO4 | 乙炔具有还原性 | |
| B | 浓硝酸 | Na2CO3 | 苯酚钠溶液 | 酸性:硝酸>碳酸>苯酚 | |
| C | 浓盐酸 | KMnO4 | FeBr2(足量) | 氧化性:Cl2>Br2 | |
| D | 浓硫酸 | 蔗糖 | 溴水 | 浓硝酸具有脱水性、氧化性 |
| A. | A | B. | B | C. | C | D. | D |
15.设NA为伏加的罗常数的值.下列说法正确的是( )
| A. | 常温下,0.05mol•L1Fe2(SO4)3溶液中含Fe3+数目小于0.1NA | |
| B. | 30g甲醛中含4NA对电子 | |
| C. | 7.8g过氧化钠中含有0.1NA个阴离子 | |
| D. | 标准状况下,22.4L乙烷含有的分子数为NA |
5.聚乳酸是一种生物降解塑料,结构简式为  .下列说法正确的是( )
.下列说法正确的是( )
 .下列说法正确的是( )
.下列说法正确的是( )| A. | 聚乳酸的相对分子质量是72 | B. | 聚乳酸的分子式是C3H4O2 | ||
| C. | 乳酸的分子式是C3H6O2 | D. | 聚乳酸可以通过水解降解 |
12.在pH=1的酸溶液和pH=13的氢氧化钠溶液中,分别加入过量的铝粉,若酸溶液放出的氢气多,其可能的原因是( )
| A. | 两溶液体积相同,酸是多元强酸 | |
| B. | 两溶液体积相同,酸是弱酸 | |
| C. | 酸是强酸,且酸溶液的浓度是碱溶液浓度的3倍以上 | |
| D. | 酸是强酸,且酸溶液的体积是碱溶液体积的3倍以上 |
10.下列有关实验操作、现象和解释或结论都正确的是( )
| 实验操作 | 现象 | 解释或结论 |
| 在稀硝酸中加入过量的铁粉,充分反应后滴入KSCN溶液 | 溶液呈红色 | HNO3将Fe氧化为Fe3+ |
| AgI沉淀中滴入KCl溶液 | 有白色沉淀出现 | AgCl比AgI更难溶 |
| Cl2通入品红溶液中 | 溶液褪色 | Cl2具有漂白性 |
| 用玻璃棒蘸取浓氨水点到红色石蕊试纸上 | 试纸变蓝色 | 浓氨水呈碱性 |
| A. | A | B. | B | C. | C | D. | D |
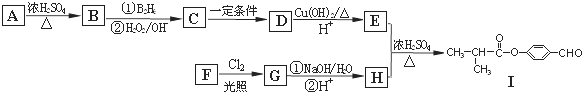
 .
. .E与H反应生成I的方程式为
.E与H反应生成I的方程式为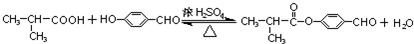 .
. HClO+H++Cl-、HClO
HClO+H++Cl-、HClO H++ClO-、Cl2(g)
H++ClO-、Cl2(g) Cl2(aq).
Cl2(aq).