题目内容
4.下列溶液混合后,常温下溶液一定呈碱性的是( )| A. | pH=12的氢氧化钠溶液与pH=2的某酸溶液等体积混合 | |
| B. | pH=2的某酸溶液与pH=12某碱溶液等体积混合 | |
| C. | pH=2的盐酸pH=12的氨水等体积混合 | |
| D. | 1×10-3mol/L的盐酸和6×10-4mol/L的Ba(OH)2溶液各取10mL,混合后再稀释100倍 |
分析 A.若酸为弱酸,则混合液中酸过量,溶液显示酸性;
B.若酸为弱酸,碱为强碱,则混合液中酸过量,溶液显示酸性;若二者都是强电解质,混合液呈中性;
C.氨水为弱碱,混合液中氨水过量,混合液呈碱性;
D.计算出两溶液中的氢离子、氢氧根离子的浓度,然后判断过量情况及溶液酸碱性.
解答 解:A.pH=12的氢氧化钠溶液与pH=2的某酸溶液等体积混合,如果该酸为弱酸,则混合液中酸过量,混合液呈酸性,故A错误;
B.pH=2的某酸溶液与pH=12某碱溶液等体积混合,若酸为弱酸、碱为强碱,则混合液显示碱性,若都是强电解质,则混合液显示中性,故B错误;
C.pH=2的盐酸pH=12的氨水等体积混合,氨水为弱碱,混合液中氨水过量,溶液一定显示碱性,故C正确;
D.1×10-3mol/L的盐酸中氢离子浓度为1×10-3mol/L,6×10-4mol/L的Ba(OH)2溶液中氢氧根离子浓度为:1.2×10-3mol/L,各取10mL混合后氢氧根离子过量,混合液一定显示碱性,故D正确;
故选CD.
点评 本题考查了溶液pH的计算、酸碱混合的定性判断,题目难度中等,注意掌握溶液酸碱性与溶液pH的关系,明确溶液pH的计算方法,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案
相关题目
15.某同学设计如下元素周期表,以下说法正确的是( )
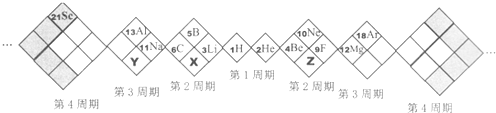

| A. | X、Y、Z元素分别为N、P、O | B. | 所列元素都是主族元素 | ||
| C. | 原子半径:Z>X>Y | D. | 稳定性:X的氢化物<Y的氢化物 |
19.在一定条件下,有可逆反应N2(g)+3H2(g)?2NH3(g).当单独改变下列条件后,有关叙述中错误的是( )
| A. | 加入氩气,V正、V逆都增大,且V正增大倍数大于V逆增大倍数 | |
| B. | 加入催化剂,V正、V逆都发生变化,且变化的倍数相同 | |
| C. | 增大压强时,V正、V逆都增大,且V正增大倍数大于V逆增大倍数 | |
| D. | 降低温度时,V正、V逆都减小,且V正减小倍数小于V逆减小倍数 |
9.下列醇能被氧化为醛类化合物的是( )
| A. | (CH3)3COH | B. | 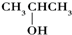 | C. | 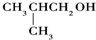 | D. | CH3CH2CH(CH3)OH |
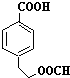
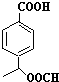
13.国际奥委会于2010年2月10日宣布,有30名运动员兴奋剂药检呈阳性,被取消参加2010年温哥华冬季奥运会的资格.以下是其中检测出的两种兴奋剂的分子结构:

关于它们的说法中正确的是( )

关于它们的说法中正确的是( )
| A. | X能发生取代反应、酯化反应、加成反应和水解反应 | |
| B. | Y分子中的所有碳原子不可能共平面 | |
| C. | X、Y均能与溴水反应 | |
| D. | X、Y均能与饱和碳酸钠溶液反应放出CO2 |
14.反应A(s)+B(g)?c(g)在密闭容器中进行,下列情况不能使反应速率加快的是( )
| A. | 升高温度 | B. | 增加A的物质的量 | ||
| C. | 使用催化剂 | D. | 缩小容器体积使压强增大 |
 ,顺丁烯二酸酐
,顺丁烯二酸酐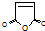 等药物中间体,广泛用于涂料行业的顺丁烯二酸二甲酯其合成流程图如下:
等药物中间体,广泛用于涂料行业的顺丁烯二酸二甲酯其合成流程图如下: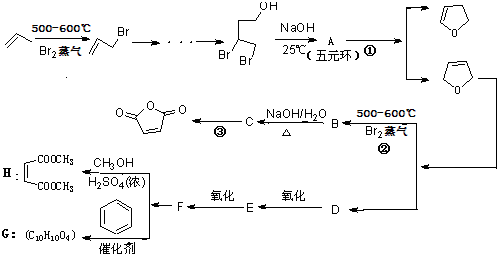
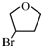 .D的结构简式HOCH2CH=CHCH2OH
.D的结构简式HOCH2CH=CHCH2OH .
.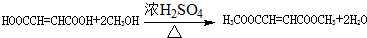 .
. 、
、 .
.