题目内容
20.下列说法正确的是( )| A. | SiO2是太阳能电池的主要原料 | |
| B. | 油脂和蛋白质都是高分子化合物 | |
| C. | 金属的镀层被破坏后,镀锌铁比镀铜铁更容易被腐蚀 | |
| D. | 明矾净水是因为能生成有吸附性的物质 |
分析 A.二氧化硅不导电;
B.油脂不属于高分子化合物;
C.当金属为原电池负极时,易发生电化学腐蚀;
D.明矾与水作用能生成氢氧化铝胶体.
解答 解:A.Si是良好的半导体材料,是太阳能电池的主要原料,故A错误;
B.油脂相对分子质量在10000以下,不属于高分子化合物,而蛋白质为高分子化合物,故B错误;
C.镀层破损后,镀铜铁形成的原电池中铁作负极被腐蚀,镀锌铁形成的原电池中铁为正极被保护,故C错误;
D.明矾与水作用能生成有吸附性的氢氧化铝胶体,能够净水,故D正确;
故选:D.
点评 本题为综合题,考查了硅、二氧化硅用途的区别、高分子化合物的判断、金属的腐蚀与防护、明矾净水的原理,熟悉原电池工作原理是解题关键,题目难度不大.

练习册系列答案
相关题目
10.人造地球卫星上使用的一种高能电池--银锌蓄电池,其电池的电极反应式为:Zn+2OH--2e-=ZnO+H2O,Ag2O+H2O+2e-=2Ag+2OH-.据此判断氧化银是( )
| A. | 负极,被氧化 | B. | 正极,被还原 | C. | 负极,被还原 | D. | 正极,被氧化 |
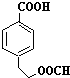
11.下列有机物中,不属于烃的衍生物的是( )
| A. | 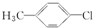 | B. | CH3CH2NO2 | C. | CH2=CHBr | D. | CΗ3-CH3 |
15.某同学设计如下元素周期表,以下说法正确的是( )
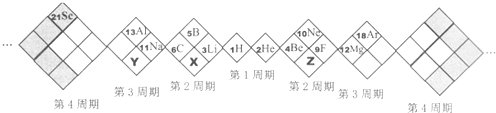

| A. | X、Y、Z元素分别为N、P、O | B. | 所列元素都是主族元素 | ||
| C. | 原子半径:Z>X>Y | D. | 稳定性:X的氢化物<Y的氢化物 |
5.如表为元素周期表的一部分,请参照元素①-⑩在表中的位置,用化学用语回答下列问题:
(1)非金属性最强的是F(填元素符号)、化学性质最不活泼的是Ar(填元素符号).
(2)由①、④、⑥、⑨中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式: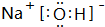 或
或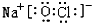 .
.
(3)②、③、⑨的最高价含氧酸的酸性由强到弱的顺序是HClO4>HNO3>H2CO3.(填化学式)
(4)表中能形成两性氢氧化物的元素是Al(填元素符号),分别写出该元素的氢氧化物与⑥、⑧最高价氧化物的水化物反应的离子方程式:Al(OH)3+OH-=AlO2-+2H2O、Al(OH)3+3H+=Al3++3H2O,
(5)请设计一个实验方案,比较④、⑧单质氧化性的强弱,并描述现象和结论:向H2S溶液中通入O2,若溶液出现浑浊,说明O2的氧化性比S强.
| 族 周期 | IA | IIA | IIIA | ⅣA | ⅤA | ⅥA | VIIA | 0 |
| 1 | ① | |||||||
| 2 | ② | ③ | ④ | ⑤ | ||||
| 3 | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(2)由①、④、⑥、⑨中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:
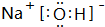 或
或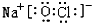 .
.(3)②、③、⑨的最高价含氧酸的酸性由强到弱的顺序是HClO4>HNO3>H2CO3.(填化学式)
(4)表中能形成两性氢氧化物的元素是Al(填元素符号),分别写出该元素的氢氧化物与⑥、⑧最高价氧化物的水化物反应的离子方程式:Al(OH)3+OH-=AlO2-+2H2O、Al(OH)3+3H+=Al3++3H2O,
(5)请设计一个实验方案,比较④、⑧单质氧化性的强弱,并描述现象和结论:向H2S溶液中通入O2,若溶液出现浑浊,说明O2的氧化性比S强.
9.下列醇能被氧化为醛类化合物的是( )
| A. | (CH3)3COH | B. | 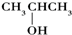 | C. | 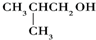 | D. | CH3CH2CH(CH3)OH |
10.下列实验操作能达到实验目的是 ( )
| 选项 | 实验目的 | 实验操作 |
| A | 检验蔗糖水解产物中的葡萄糖 | 取1ml 20%蔗糖溶液,加入少量稀硫酸,水浴加热后取少量溶液,加入几滴新制Cu(OH)2,加热 |
| B | 除去乙烷中混有的少量乙烯 | 将混合气体通入足量酸性KMnO4溶液中 |
| C | 验证Mg(OH)2沉淀可以转化为Fe(OH)3沉淀 | 向2ml 1mol/L NaOH溶液中加入几滴1mol/L MgCl2溶液,生成白色沉淀,再加入几滴1mol/LFeCl3 |
| D | 硅酸胶体的制备 | 向Na2SiO3溶液(饱和溶液1:2用水稀释)中加入几滴酚酞,再逐滴滴入盐酸,边加边震荡,至溶液红色变浅并接近消失 |
| A. | A | B. | B | C. | C | D. | D |
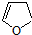 ,顺丁烯二酸酐
,顺丁烯二酸酐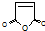 等药物中间体,广泛用于涂料行业的顺丁烯二酸二甲酯其合成流程图如下:
等药物中间体,广泛用于涂料行业的顺丁烯二酸二甲酯其合成流程图如下: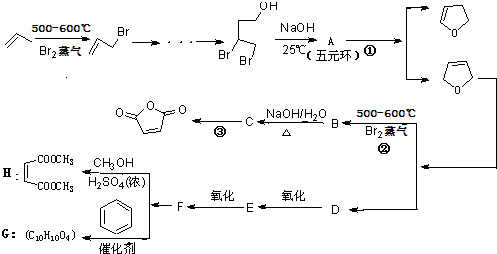
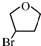 .D的结构简式HOCH2CH=CHCH2OH
.D的结构简式HOCH2CH=CHCH2OH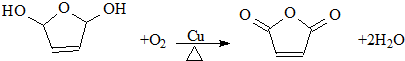 .
.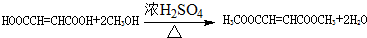 .
. 、
、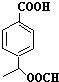 .
.