题目内容
6.在Al2(SO4)3、K2SO4、KAl(SO4)2的混合溶液100mL中,如果SO42-的浓度等于0.4mol/L,当加入2mol/L的KOH溶液50mL时,生成沉淀恰好溶解,则原混合物中K+的物质的量浓度是( )| A. | 0.2mol/L | B. | 0.05mol/L | C. | 0.45mol/L | D. | 0.225mol/L |
分析 当加入2mol/L的KOH溶液50mL时,生成沉淀恰好溶解,发生反应Al3++4OH-=AlO2-+2H2O,此时溶液中溶质为硫酸钾、偏铝酸钾,原溶液中n(Al3+)=$\frac{1}{4}$×2mol/L×0.05L=0.025mol,根据原溶液中电荷守恒可知溶液中c(K+)+3c(Al3+)=2c(SO42-),以此计算.
解答 解:当加入2mol/L的KOH溶液50mL时,生成沉淀恰好溶解,发生反应Al3++4OH-=AlO2-+2H2O,此时溶液中溶质为硫酸钾、偏铝酸钾,原溶液中n(Al3+)=$\frac{1}{4}$×2mol/L×0.05L=0.025mol,则c(Al3+)=0.25mol/L,原溶液中电荷守恒可知溶液中c(K+)+3c(Al3+)=2c(SO42-),c(K+)=2×0.4mol/L-0.25mol/L×3=0.05mol/L,
故选B.
点评 本题考查有关混合物的计算,为高频考点,注意铝离子物质的量的计算和电荷守恒的角度解答是解题的关键,题目难度不大.

练习册系列答案
 优等生题库系列答案
优等生题库系列答案 53天天练系列答案
53天天练系列答案
相关题目
17.X、Y、Z三种元素的原子,其核外电子排布分别为:X最外层有1个电子,Y有3个电子层,最外层电子数比次外层的少3,Z的最外层电子数是次外层的3倍.由这三种元素组成的化合物的化学式不可能是( )
| A. | XYZ2 | B. | XYZ3 | C. | X2YZ2 | D. | X3YZ3 |
11.某温度下,NaOH的溶解度为ag,该温度下,用bg水溶解一定量的Na2O2形成饱和溶液,需加入的Na2O2的质量为( )
| A. | $\frac{39ab}{4000-9a}$g | B. | $\frac{ab}{100}$g | C. | $\frac{39ab}{4000}$g | D. | $\frac{39ab}{4000+9a}$g |
18.由FeO、Fe2O3和Fe3O4组成的混合物,测得其铁元素与氧元素的质量比为21:8,则混合物中FeO、Fe2O3和Fe3O4的物质的量之比可能是( )
| A. | 1:2:1 | B. | 2:1:1 | C. | 2:1:2 | D. | 2:2:5 |
15.取四份质量均为25g、含溶质的质量分数都为41%的稀硫酸,分别加入下列物质至恰好反应完全.若反应中产生的气体全部放出,则所得溶液中含溶质的质量分数最小的是( )
| A. | Mg | B. | MgO | C. | Mg(OH)2 | D. | MgCO3 |
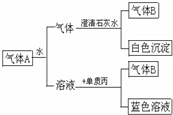
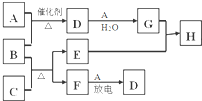 下图涉及的物质所含元素中,除一种元素外,其余均为短周期元素.已知:A、F为无色气体单质,B为能使湿润红色石蕊试纸变蓝的气体,C为黑色氧化物,E为红色金属单质,H为蓝色溶液(部分反应的产物未列出).请回答下列问题:
下图涉及的物质所含元素中,除一种元素外,其余均为短周期元素.已知:A、F为无色气体单质,B为能使湿润红色石蕊试纸变蓝的气体,C为黑色氧化物,E为红色金属单质,H为蓝色溶液(部分反应的产物未列出).请回答下列问题: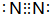 .
.


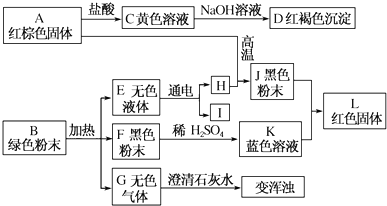
 如图所示将红热固体单质甲,投入显黄色的溶液乙中,剧烈反应产生混合气体A,A在常温下不与空气反应,根据下列变化填空:
如图所示将红热固体单质甲,投入显黄色的溶液乙中,剧烈反应产生混合气体A,A在常温下不与空气反应,根据下列变化填空: