题目内容
1.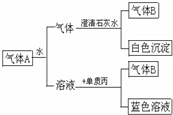 如图所示将红热固体单质甲,投入显黄色的溶液乙中,剧烈反应产生混合气体A,A在常温下不与空气反应,根据下列变化填空:
如图所示将红热固体单质甲,投入显黄色的溶液乙中,剧烈反应产生混合气体A,A在常温下不与空气反应,根据下列变化填空:(1)甲是C,乙是HNO3(浓),丙是Cu;
(2)混合气体A的主要成分是CO2、NO2;
(3)气体B是NO,蓝色溶液是Cu(NO3)2.
分析 单质丙和溶液反应生成蓝色溶液,则该蓝色溶液中含有铜离子,该溶液为气体A和水反应生成的,则该溶液应该是酸,则丙是Cu,铜和稀硝酸在常温下反应,则该溶液为HNO3,气体B是NO,根据元素守恒知,A中含有NO2,通入水后的A中气体能和澄清石灰水反应生成白色沉淀,且还剩余NO,根据元素守恒及物质颜色知,甲是C,乙是浓硝酸,则A中含有CO2、NO2,结合对应物质的性质以及题目要求解答该题.
解答 解:单质丙和溶液反应生成蓝色溶液,则该蓝色溶液中含有铜离子,该溶液为气体A和水反应生成的,则该溶液应该是酸,则丙是Cu,铜和稀硝酸在常温下反应,则该溶液为HNO3,气体B是NO,根据元素守恒知,A中含有NO2,通入水后的A中气体能和澄清石灰水反应生成白色沉淀,且还剩余NO,根据元素守恒及物质颜色知,甲是C,乙是浓硝酸,则A中含有CO2、NO2,
(1)根据以上分析知,甲、乙、丙分别是:C、HNO3(浓)、Cu,故答案为:C;HNO3(浓);Cu;
(2)由以上分析可知,A中含有CO2、NO2,故答案为:CO2、NO2;
(3)B为NO,蓝色溶液是Cu(NO3)2,故答案为:NO;Cu(NO3)2.
点评 本题考查无机物的推断,为高考常见题型,侧重学生的分析能力的考查,涉及碳、氮元素单质及化合物的性质,E溶液为蓝色是推断的突破口,据此可以推断丙,再结合转化关系确定乙为硝酸,熟练掌握元素化合物的性质是关键.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
19.下列离子在溶液中可以大量共存的一组是( )
| A. | NH4+ Na+ OH- | B. | Na+ H+ SO32- | ||
| C. | K+ NO3- Cl- | D. | Ca2+ NO3- CO32- |
12.在氧化还原反应中,下列叙述正确的是( )
| A. | 物质失电子的反应为氧化反应 | |
| B. | 物质在变化中失去了电子,此物质是氧化剂 | |
| C. | 发生电子转移的反应即是氧化还原反应 | |
| D. | 发生化合价升降的反应不一定是氧化还原反应 |
9.下表是元素周期表的一部分,有关说法正确的是 ( )
| 族 周期 | IA | ⅡA | ⅢA | ⅣA | VA | VⅠA | VⅡA |
| 2 | a | b | c | ||||
| 3 | d | e | f | g | h | i |
| A. | a、b、e、f四种元素的原子半径:e>f>b>a | |
| B. | h、i两种元素阴离子的还原性:h>i | |
| C. | a、g两种元素氢化物的稳定性:g>a | |
| D. | d、e、f三种元素最高价氧化物对应的水化物的碱性依次增强 |
16.含硫48%的硫铁矿煅烧时FeS2损失率为2%,则下列说法不正确的是( )
| A. | 该硫铁矿含FeS2也是48% | B. | 硫损失也是2% | ||
| C. | 铁损失也是2% | D. | 该硫铁矿含铁42% |
6.在Al2(SO4)3、K2SO4、KAl(SO4)2的混合溶液100mL中,如果SO42-的浓度等于0.4mol/L,当加入2mol/L的KOH溶液50mL时,生成沉淀恰好溶解,则原混合物中K+的物质的量浓度是( )
| A. | 0.2mol/L | B. | 0.05mol/L | C. | 0.45mol/L | D. | 0.225mol/L |
10.下列说法中,正确的是( )
| A. | 原子是化学变化中的最小微粒 | |
| B. | 分子是化学变化中的最小微粒 | |
| C. | 原子是可分成更小粒子的实心球 | |
| D. | 原子是构成一切物质的基本粒子,是构成物质的最小粒子 |
11.下列实验中,金属或固体可以完全溶解的是( )
| A. | 在H2O2溶液中加入少量MnO2粉末 | |
| B. | 镁铝合金加入足量的NaOH溶液中 | |
| C. | 1 mol铜片与含2 molH2SO4的浓硫酸共热 | |
| D. | 常温下1 mol铜片投入含4 molHNO3的浓硝酸中 |