题目内容
16.某考古兴趣小组为了研究从某建设工地出土的文物,对两件文物的表面物A和B进行了如下图所示的实验: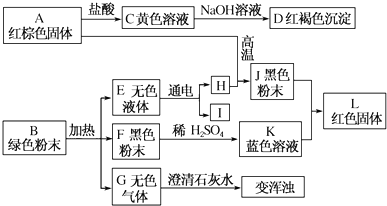
(1)推断出下列物质的化学式:
BCu2(OH)2CO3;DFe(OH)3;FCuO;JFe.
(2)写出下列反应的离子方程式:
C→DFe3++3OH-═Fe(OH)3↓;
J+K→LFe+Cu2+═Cu+Fe2+.
分析 根据无色气体G与石灰水会出现浑浊,所以G是二氧化碳,黄色溶液C和氢氧化钠会生成D是红褐色沉淀,所以D就是氢氧化铁,C中含有铁离子,红棕色固体A和盐酸会生成C,所以C是氯化铁,A就是氧化铁,K是蓝色溶液,说明K中含有铜离子,黑色粉末F和硫酸会生成K,所以K是硫酸铜,F是氧化铜,无色液体E通电会生成H和I,所以E就是水,H和I是氢气和氧气,H和氧化铁会生成黑色固体J,所以H是氢气,I是氧气,J就是铁,绿色粉末B分解会生成氧化铜、二氧化碳、水,所以B就是碱式碳酸铜,将各种物质进行验证即可.
解答 解:根据无色气体G与石灰水会出现浑浊,所以G是二氧化碳,黄色溶液C和氢氧化钠会生成D是红褐色沉淀,所以D就是氢氧化铁,C中含有铁离子,红棕色固体A和盐酸会生成C,所以C是氯化铁,A就是氧化铁,K是蓝色溶液,说明K中含有铜离子,黑色粉末F和硫酸会生成K,所以K是硫酸铜,F是氧化铜,无色液体E通电会生成H和I,所以E就是水,H和I是氢气和氧气,H和氧化铁会生成黑色固体J,所以H是氢气,I是氧气,J就是铁,绿色粉末B分解会生成氧化铜、二氧化碳、水,所以B就是碱式碳酸铜,
(1)根据上面的分析可知,B就是碱式碳酸铜,化学式为Cu2(OH)2CO3,D是氢氧化铁,化学式为Fe(OH)3,F是氧化铜,化学式为CuO,J是铁,化学式为Fe,
故答案为:Cu2(OH)2CO3;Fe(OH)3;CuO;Fe;
(2)C→D的离子反应方程式为Fe3++3OH-═Fe(OH)3↓,J+K→L的离子方程式为Fe+Cu2+═Cu+Fe2+,
故答案为:Fe3++3OH-═Fe(OH)3↓;Fe+Cu2+═Cu+Fe2+.
点评 本题考查元素化合物的特性和反应,主要涉及铜、铁的相关知识,能根据物质的颜色和状态及相互转化关系正确判断化合物是解本题的关键,题目难度中等.

| A. | 0.2mol/L | B. | 0.05mol/L | C. | 0.45mol/L | D. | 0.225mol/L |
| A. | 玻璃态是水的一种特殊状态 | B. | 水由液态变为玻璃态,体积膨胀 | ||
| C. | 水由液态变为玻璃态,体积缩小 | D. | 玻璃态水是分子晶体 |

| A. | 图中a点溶液中各离子浓度的关系是:c(OH-)=c(H+)+c(CH3COO-)+2c(CH3COOH) | |
| B. | pH相同的①CH3COONa、②NaHCO3、③ 三份溶液中的c(Na+):③>②>① 三份溶液中的c(Na+):③>②>① | |
| C. | 图中pH=7时:c(Na+)>c(CH3COO-)>c(OH-)=c(H+) | |
| D. | 图中V(CH3COOH)>20mL,溶液pH<7 |
| A. | 在H2O2溶液中加入少量MnO2粉末 | |
| B. | 镁铝合金加入足量的NaOH溶液中 | |
| C. | 1 mol铜片与含2 molH2SO4的浓硫酸共热 | |
| D. | 常温下1 mol铜片投入含4 molHNO3的浓硝酸中 |
| A. | 溴乙烷和甲醇都能发生消去反应 | |
| B. | 乙烯和苯都能与酸性KMnO4溶液发生反应 | |
| C. | 纤维素和油脂的水解产物都是葡萄糖 | |
| D. | 糖类和蛋白质都是人体需要的营养物质 |
| A. | 溶质的质量分数为w=$\frac{a}{Vρ-a}$×100% | |
| B. | 溶质的物质的量浓度c=$\frac{1000a}{17V}$ mol•L-1 | |
| C. | 溶液中c(OH-)=$\frac{1000b}{V}$ mol•L-1 | |
| D. | 上述溶液中再加入V mL水后,所得溶液溶质的质量分数大于0.5w |

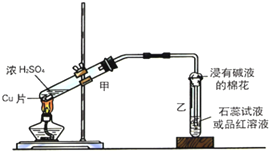 实验室常用下列装置来进行铜跟浓硫酸反应等一系列实验.
实验室常用下列装置来进行铜跟浓硫酸反应等一系列实验.