题目内容
17.Cu2S与一定浓度的HNO3反应,生成Cu(NO3)2、CuSO4、NO2、NO和H2O.当产物n(NO2):n(NO)=1:1时,下列说法不正确的是( )| A. | 反应中Cu2S只做还原剂 | |
| B. | 参加反应的n(Cu2S):n(HNO3)=1:5 | |
| C. | 产物n[Cu(NO3)2]:n[CuSO4]=1:1 | |
| D. | 1 molCu2S参加反应时有10 mol电子转移 |
分析 由信息可知,n(NO2):n(NO)=1:1,假定生成1molNO2、1molNO;则HNO3被还原生成1molNO2、1molNO共得4mole-;Cu2S应失4mole-.而1molCu2S能失10mole-,故失4mole-说明反应的Cu2S的物质的量为0.4mol,0.4molCu2S生成0.4molCuSO4和0.4molCu(NO3)2;即起酸性作用的HNO3的物质的量为0.8mol,起氧化作用的HNO3为2mol.反应的HNO3共2.8mol,故n(Cu2S):n(HNO3)=0.4mol:2.8mol=2:14,则发生2Cu2S+14HNO3=2Cu(NO3)2+2CuSO4+5NO2↑+5N0↑+7H2O,Cu、S元素的化合价升高,N元素的化合价降低,结合化学方程式的定量关系和氧化还原反应关系分析判断.
解答 解:A.Cu、S元素的化合价升高,则Cu2S做还原剂,故A正确;
B.由2Cu2S+14HNO3=2Cu(NO3)2+2CuSO4+5NO2↑+5N0↑+7H2O可知,参加反应的n(Cu2S):n(HNO3)=2:14,故B错误;
C.由发生的反应可知,产物n[Cu(NO3)2]:n[CuSO4]=1:1,故C正确;
D.1 molCu2S参加反应时有1mol×2×(2-1)+1mol×[6-(-2)]=10mol电子转移,故D正确;
故选B.
点评 本题考查氧化还原反应,把握发生的反应及反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念及转移电子的考查,综合性较强,题目难度中等大.

练习册系列答案
相关题目
3.禁止用工业酒精配制饮料酒,这是因为工业酒精中常含有会使人中毒的( )
| A. | 乙醇 | B. | 乙酸 | C. | 乙酸乙酯 | D. | 甲醇 |
5.电池是人类生产和生活中的重要能量来源,各式各样电池的发明是化学对人类的一项重大贡献,下列有关电池的叙述正确的是( )
| A. | 锌锰干电池工作一段时间后碳棒变细 | |
| B. | 氢氧燃料电池可将热能直接转变为电能 | |
| C. | 太阳能电池的主要材料是高纯度的二氧化硅 | |
| D. | 氢氧燃料电池工作时氢气在负极被氧化 |
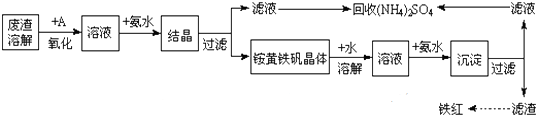
12.用含有Al2O3、SiO2和少量FeO•xFe2O3的铝灰制备Al2(SO4)3•18H2O.制备步骤如下(部分操作和条件略):
I.向铝灰中加入过量稀H2SO4,过滤;
II.向滤液中加入过量KMnO4溶液,调节溶液的pH约为3;
III.加热,产生大量棕色沉淀,静置,上层溶液呈紫红色;
IV.加入MnSO4至紫红色消失,过滤;
V.浓缩、结晶、分离,得到产品.
(1)步骤Ⅰ过滤得到沉淀的主要成分SiO2(填化学式),H2SO4溶解Al2O3的离子方程式是Al2O3+6H+=2Al3++3H2O.
(2)已知:生成氢氧化物沉淀的pH
注:金属离子的起始浓度为0.1mol•L-1
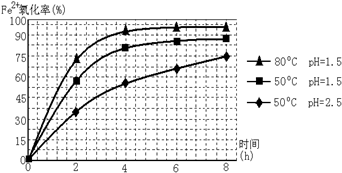
根据表中数据解释步骤II的目的pH约为3时,Fe2+和Al3+不能形成沉淀,将Fe2+氧化为Fe3+,可使铁完全沉淀.
(3)己知:一定条件下,MnO4-可与Mn2+反应生成MnO2,
①向Ⅲ的沉淀中加入浓HCl并加热,能说明沉淀中存在MnO2的现象是生成黄绿色气体.反应的化学方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ MnCl2+2H2O+Cl2↑
②Ⅳ中加入MnSO4的目的是除去过量的MnO4-.
I.向铝灰中加入过量稀H2SO4,过滤;
II.向滤液中加入过量KMnO4溶液,调节溶液的pH约为3;
III.加热,产生大量棕色沉淀,静置,上层溶液呈紫红色;
IV.加入MnSO4至紫红色消失,过滤;
V.浓缩、结晶、分离,得到产品.
(1)步骤Ⅰ过滤得到沉淀的主要成分SiO2(填化学式),H2SO4溶解Al2O3的离子方程式是Al2O3+6H+=2Al3++3H2O.
(2)已知:生成氢氧化物沉淀的pH
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
根据表中数据解释步骤II的目的pH约为3时,Fe2+和Al3+不能形成沉淀,将Fe2+氧化为Fe3+,可使铁完全沉淀.
(3)己知:一定条件下,MnO4-可与Mn2+反应生成MnO2,
①向Ⅲ的沉淀中加入浓HCl并加热,能说明沉淀中存在MnO2的现象是生成黄绿色气体.反应的化学方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ MnCl2+2H2O+Cl2↑
②Ⅳ中加入MnSO4的目的是除去过量的MnO4-.
2.2000年,国家药品监督管理局发布通告暂停使用和销售含苯丙醇胺的药品制剂.苯丙醇胺(英文缩写为PPA)结构简式如下: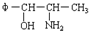 将φ-、H2N-、HO-在碳链上的位置作变换,可以写出多种同分异构体,共有多少种( )
将φ-、H2N-、HO-在碳链上的位置作变换,可以写出多种同分异构体,共有多少种( )
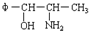 将φ-、H2N-、HO-在碳链上的位置作变换,可以写出多种同分异构体,共有多少种( )
将φ-、H2N-、HO-在碳链上的位置作变换,可以写出多种同分异构体,共有多少种( )| A. | 5 | B. | 7 | C. | 8 | D. | 9 |
9.下列反应不属于消去反应的是( )
| A. | CH3CH2OH$→_{170℃}^{浓硫酸}$CH2═CH2↑+H2O | |
| B. | CH3CHBrCH3+NaOH$→_{△}^{乙醇}$CH3CH═CH2↑+NaBr+H2O | |
| C. | 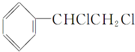 +2NaOH$→_{△}^{乙醇}$ +2NaOH$→_{△}^{乙醇}$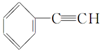 +2NaCl+2H2O +2NaCl+2H2O | |
| D. | 2CH3OH$→_{△}^{浓硫酸}$CH3-O-CH3+H2O |
6.某些电解质分子的中心原子最外层电子未达饱和结构,其电离采取结合溶液中其他离子的形式,而使中心原子最外层电子达到饱和结构.例如:硼酸分子的中心原子B最外层电子并未达到饱和,它在水中的电离过程为:
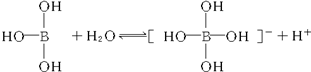
下列判断正确的是( )
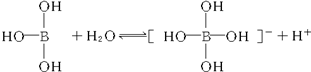
下列判断正确的是( )
| A. | 凡是酸或碱对水的电离都是抑制的 | |
| B. | 硼酸分子中除氢原子外每个其他原子最外层都满足8电子稳定结构 | |
| C. | 硼酸溶液与NaOH溶液反应的离子方程式为:H3BO3+OH-═[B(OH)4]- | |
| D. | 硼酸是两性化合物 |
7.有下列两组命题
B组命题正确且能用A组命题给以正确解释的是( )
①Ⅰa ②Ⅱb ③Ⅲc ④Ⅳd.
| A组 | B组 |
| Ⅰ.H-I键键能大于H-Cl键能 Ⅱ.H-I键键能小于H-Cl键能 Ⅲ.HI分子间作用力大于HCl分子间作用力 Ⅳ.HI分子间作用力小于HCl分子间作用力 | a.HI比HCl稳定 b.HCl比HI稳定 c.HI沸点比HCl高 d.HI沸点比HCl低 |
①Ⅰa ②Ⅱb ③Ⅲc ④Ⅳd.
| A. | ①③ | B. | ②③ | C. | ①④ | D. | ②④ |