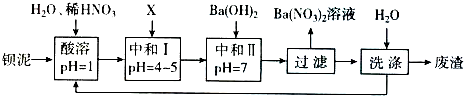
题目内容
4.等体积、等浓度的浓硫酸分别与足量的炭粉、铜粉在一定条件下完全反应.下列指定“物理量”之比不是2:1的是( )| A. | 转移电子的物质的量 | B. | 产生SO2的物质的量 | ||
| C. | 氧化剂的物质的量 | D. | 生成水的物质的量 |
分析 等体积、等浓度的浓硫酸其物质的量相等,在加热条件下浓硫酸和C、Cu反应方程式分别为C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$2SO2↑+CO2↑+2H2O、Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,碳和浓硫酸的反应中浓硫酸完全作氧化剂、Cu和浓硫酸的反应中浓硫酸一半作氧化剂,据此分析解答.
解答 解:等体积、等浓度的浓硫酸其物质的量相等,在加热条件下浓硫酸和C、Cu反应方程式分别为 C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$2SO2↑+CO2↑+2H2O、Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,碳和浓硫酸的反应中浓硫酸完全作氧化剂、Cu和浓硫酸的反应中浓硫酸一半作氧化剂,
A.根据以上分析知,如果有2mol浓硫酸反应,第一个方程式中转移电子物质的量与第二个方程式转移电子物质的量之比为4:2=2:1,故A不选;
B.C和浓硫酸的反应中,浓硫酸完全被还原生成二氧化硫,Cu和浓硫酸的反应中只有一半的浓硫酸被还原生成二氧化硫,所以第一个方程式中产生二氧化硫后第二个方程式中产生二氧化硫物质的量之比为2:1,故B不选;
C.碳和浓硫酸的反应中浓硫酸完全作氧化剂、Cu和浓硫酸的反应中浓硫酸一半作氧化剂,氧化剂的物质的量之比为2:1,故C不选;
D.两个方程式中,浓硫酸中H元素都完全转化为水,所以生成水的物质的量之比为1:1,故D选,
故选D.
点评 本题以浓硫酸的性质为载体考查化学方程式的有关计算,明确浓硫酸的作用是解本题关键,利用方程式分析判断即可,侧重考查学生分析判断能力,题目难度不大.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案| A. | 将少量SO2气体通入NaClO溶液中:SO2+2ClO-+H2O═SO32-+2HClO | |
| B. | 硫酸氢铵溶液中加入过量氢氧化钠溶液:NH4++H++2OH-═H2O+NH3•H2O | |
| C. | 两极均用铁棒电解饱和食盐水:2Cl-+2H2O═2OH-+H2↑+Cl2↑ | |
| D. | 向Mg(HCO3)2溶液中加入过量的苛性钠溶液:Mg2++2HCO3-+2OH-═MgCO3↓+CO32-+2H2O |
| A. | 44 | B. | 42 | C. | 54 | D. | 126 |
| A. | 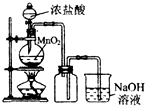 制备并收集Cl2 | B. |  制备氨气 | ||
| C. | 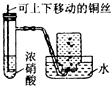 制备并收集NO2气体 | D. |  制备氧气 |
| A. | 2NA个H2与NA个O2的质量比为1:8 | |
| B. | 0.5NA个HCl所占的体积约为11.2L | |
| C. | 71gCl2所含的Cl数目为2NA | |
| D. | 1L 0.5mol•L-1FeCl3溶液中含有1.5NA个Cl- |