题目内容
16.在一个容积可变的密闭容器中充入NO、O2,使其发生反应,反应达到平衡状态之后向该容器中加入Ar,分析化学反应速率如何变化?分析 在一个容积可变的密闭容器中充入NO、O2,使其发生反应,反应达到平衡状态后,再充入Ar,Ar不参加反应,但因为容器压强不变导致容器体积增大,在加入Ar的瞬间,NO、O2的物质的量不变但容器体积增大导致NO、O2的浓度降低,该反应中反应物浓度与化学反应速率成正比,据此分析解答.
解答 解:在一个容积可变的密闭容器中充入NO、O2,使其发生反应,反应达到平衡状态后,再充入Ar,Ar不参加反应,但因为容器压强不变导致容器体积增大,在加入Ar的瞬间,NO、O2的物质的量不变但容器体积增大导致NO、O2的浓度降低,该反应中反应物浓度与化学反应速率成正比,所以导致该反应速率降低,
答:容器压强不变,加入Ar,导致容器中气体总物质的量增大,容器体积增大,反应物浓度降低,反应速率减小.
点评 本题考查化学反应速率影响因素,为高频考点,明确压强对化学反应速率影响原理是解本题关键,加入稀有气体时,只有能改变反应物浓度的才能影响化学反应速率,否则不影响化学反应速率,为易错题.

练习册系列答案
相关题目
6.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 28g CO含有的原子数为NA | |
| B. | 标准状况下22.4L水中含有的H2O分子数为NA | |
| C. | 1mol Fe与足量盐酸反应失去的电子数为2NA | |
| D. | 0.1L 2mol/L NaCl溶液中含有Na+个数为2NA |
7.金属汞在加热条件下能和氧气化合生成氧化汞,反应如下:2Hg+O2═2HgO,下列哪个选项可以说明0.4molHg 与 0.4molO2充分反应后物质的种类及其量的情况.( )
| A. | 0.1molHgO与0.3molHg | B. | 0.2molHgO与0.2mol Hg | ||
| C. | 0.4molHgO与0.2mol O2 | D. | 0.4molHgO |
4.等体积、等浓度的浓硫酸分别与足量的炭粉、铜粉在一定条件下完全反应.下列指定“物理量”之比不是2:1的是( )
| A. | 转移电子的物质的量 | B. | 产生SO2的物质的量 | ||
| C. | 氧化剂的物质的量 | D. | 生成水的物质的量 |
11.在室温下,向纯水中加入少量硫酸氢钾固体,下列叙述正确的是( )
| A. | pH值增大 | B. | 水电离出的c(H+)减小 | ||
| C. | c(OH-)增大 | D. | c(H+)•c(OH-)的值增大 |
1.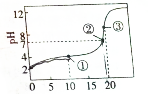 25℃时,向20mL0.2mo•lL-1HR溶液中逐渐滴入0.2mol•L-1NaOH溶液,得到如图的滴定曲线.下列粒子浓度的关系式错误的是( )
25℃时,向20mL0.2mo•lL-1HR溶液中逐渐滴入0.2mol•L-1NaOH溶液,得到如图的滴定曲线.下列粒子浓度的关系式错误的是( )
 25℃时,向20mL0.2mo•lL-1HR溶液中逐渐滴入0.2mol•L-1NaOH溶液,得到如图的滴定曲线.下列粒子浓度的关系式错误的是( )
25℃时,向20mL0.2mo•lL-1HR溶液中逐渐滴入0.2mol•L-1NaOH溶液,得到如图的滴定曲线.下列粒子浓度的关系式错误的是( )| A. | 点①溶液中,c(HR)+2c(H+)=c(R-)+2c(OH-) | |
| B. | 点②溶液中,c(Na+)=c(HR)+c(R-) | |
| C. | 点③溶液中,c(Na+)>c(R-)>(OH-)>c(H+) | |
| D. | 滴定过程中可能会出现,c(HR)>c(R-)>(H+)>c(Na+) |