题目内容
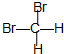
15.下列数值都是烃的相对分子质量,其对应的烃一定是烷烃的是( )| A. | 44 | B. | 42 | C. | 54 | D. | 126 |
分析 烷烃是饱和烃,烷烃的通式是:CnH2n+2,将各式量代入CnH2n,余数为2的其对应的烃一定是烷烃.
解答 解:烷烃的通式为CnH(2n+2),A.14n=44,解得n=3余2,符合烷烃的通式是:CnH2n+2,分子式为C3H8,其对应的烃为丙烷,故A正确;
B.14n=42,解得n=3,分子式为C3H6,其对应的烃为丙烯或环烷烃,故B错误;
C.14n=54,解得n=4,少2,分子式为C4H6,其对应的烃为丁炔或二烯烃等,故C错误;
D.14n=126,解得n=9,分子式为C9H18,其对应的烃为壬烯或环壬烷,故D错误;
故选A.
点评 本题考查了烷烃通式的应用,题目难度不大,注重了基础知识的考查,可以根据烷烃的通式CnH(2n+2)完成,要求学生掌握常见的各类有机物的结构特点及通式.

练习册系列答案
 导学与测试系列答案
导学与测试系列答案 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案
相关题目
5.把0.05mol NaOH晶体分别加入到下列100mL液体中,溶液导电性变化最大的是( )
| A. | 自来水 | B. | 0.5 mol/L盐酸 | C. | 0.5 mol/LH2SO4 | D. | 0.5 mol/L NaNO3 |
6.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 28g CO含有的原子数为NA | |
| B. | 标准状况下22.4L水中含有的H2O分子数为NA | |
| C. | 1mol Fe与足量盐酸反应失去的电子数为2NA | |
| D. | 0.1L 2mol/L NaCl溶液中含有Na+个数为2NA |
10.在标准状况下,进行甲、乙、丙三组实验.三组实验各取30ml同浓度的盐酸溶液,然后分别慢慢加入不同质量的同一种镁铝合金粉末.有关数据见表.
(1)甲组实验中,盐酸过量(填“过量”、或“不足量”),乙组实验中,盐酸不足量(填“过量”、或“不足量”),
(2)选择合适数据,可求得的盐酸物质的量浓度是1mol/L.
(3)选择合适数据,可计算出镁铝的物质的量之比为1:1.
(4)丙组实验后,向容器中加入一定量1.00mol•L-lNaOH溶液,恰好使铝元素全部以A1O2-形式存在,并使Mg2+刚好沉淀完全,则溶液中NaCl的物质的量为0.03mol.
| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量/mg | 255 | 385 | 459 |
| 生成气体体积/ml | 280 | 336 | 336 |
(2)选择合适数据,可求得的盐酸物质的量浓度是1mol/L.
(3)选择合适数据,可计算出镁铝的物质的量之比为1:1.
(4)丙组实验后,向容器中加入一定量1.00mol•L-lNaOH溶液,恰好使铝元素全部以A1O2-形式存在,并使Mg2+刚好沉淀完全,则溶液中NaCl的物质的量为0.03mol.
20.下列关于化学用语的表示正确的是( )
| A. | 过氧化钠的电子式:Na${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$Na | |
| B. | 质子数为35、中子数为45的溴原子:${\;}_{35}^{80}$Br | |
| C. | 硫离子的结构示意图: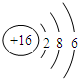 | |
| D. | 间二甲苯的结构简式: |
7.金属汞在加热条件下能和氧气化合生成氧化汞,反应如下:2Hg+O2═2HgO,下列哪个选项可以说明0.4molHg 与 0.4molO2充分反应后物质的种类及其量的情况.( )
| A. | 0.1molHgO与0.3molHg | B. | 0.2molHgO与0.2mol Hg | ||
| C. | 0.4molHgO与0.2mol O2 | D. | 0.4molHgO |
4.等体积、等浓度的浓硫酸分别与足量的炭粉、铜粉在一定条件下完全反应.下列指定“物理量”之比不是2:1的是( )
| A. | 转移电子的物质的量 | B. | 产生SO2的物质的量 | ||
| C. | 氧化剂的物质的量 | D. | 生成水的物质的量 |
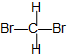 和
和