题目内容
19.钡盐行业生产中排出大量的钡泥(主要含有BaCO3、BaSiO3、BaSO3、Ba(FeO2)2等).某主要生产BaCl2、BaCO3、BaSO4的化工厂利用钡泥制取Ba(NO3)2,其部分工艺流程如下: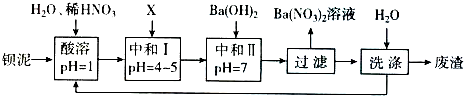
(1)酸溶后溶液中pH=1,Ba(FeO2)2与HNO3的反应的离子方程式为Ba(FeO2)2+8HNO3=Ba(NO3)2+2Fe( NO3)3+4H2O;
(2)向上述酸溶后的溶液中加入X,控制pH在4~5范围.用离子方程式表示加X调节pH的过程BaCO3+2H+═Ba2++H2O+CO2↑;
(3)酸溶过程钡泥中有一种成分没有溶解,这种成分是BaSO3;
(4)对于Ba2++2NO3-+3SO2+2H2O═BaSO4↓+2NO↑+4H++2SO42-反应,在酸性条件下NO3-氧化性比SO42-氧化性强(填“强”或“弱”);
(5)配平下列反应方程式:2NH4++3O2+4OH-═2NO2-+6H2O;
(6)酸溶时BaSO3会和硝酸发生氧化还原反应,1mol BaSO3被氧化时被还原HNO3的物质的量是0.67(若不能整除则保留两位小数);
(7)一定条件下,向废水中加入CH3OH,将HNO3还原成N2,若该反应消耗32g CH3OH转移6mol电子,则参加反应的还原剂和氧化剂的物质的量之比是5:6;
(8)若用9.6g铜和50mL一定物质的量浓度的硝酸反应,铜溶解后放出2240mL标准状况下的NO2、NO气体,将溶液稀释为500mL,测得溶液的pH=1,则原硝酸的物质的量浓度为9mol/L.
分析 钡泥主要含BaCO3、BaSiO3、Ba(FeO2)2等,加入硝酸,在容器中充分溶解,可生成硝酸钡,过滤后滤液中含有铁离子、钡离子等,且溶液呈酸性,可加入碳酸钡,调节溶液pH=4~5,使铁离子水解生成Fe(OH)3沉淀,过滤后废渣为Fe(OH)3,滤液中含有硝酸、硝酸钡等,加入氢氧化钡中和得到硝酸钡溶液,经蒸发、浓缩、过滤可得到硝酸钡晶体,母液中含有硝酸钡,过滤得到的固体洗涤后除去废渣,滤液重新加入酸溶步骤充分利用.
(1)Ba(FeO2)2中Fe元素是+3价,钡元素为+2价,与HNO3反应发生复分解反应;
(2)X既要能中和硝酸,又不产生新杂质,结合本厂实际,故可用BaCO3;
(3)BaSO3可被硝酸氧化生成硫酸钡;
(4)氧化剂的氧化性大于氧化产物的氧化性;
(5)根据化合价升降相等配平;
(6)发生反应为3BaSO3+2H++2NO3-=3BaSO4+2NO↑+H2O,反应中S元素化合价由+4价升高到+6价,N元素化合价由+5价降低到+2价,根据氧化还原反应中氧化剂和还原剂得失电子数目相等,表现为化合价升降总数相等计算;
(7)32gCH30H转移6mol电子,即1mol还原剂参加反应转移6mol电子,根据消耗甲醇的量和转移电子的量来书写方程式,并确定氧化剂和还原剂的量的多少;
(8)反应后剩余硝酸的物质的量为0.05mol,根据氮原子守恒可知n(HNO3)=n(HNO3)剩余+n(CuNO3)×2+n(NO2+NO),再根据c=$\frac{n}{V}$计算.
解答 解:(1)Ba(FeO2)2中Fe元素是+3价,钡元素为+2价,故Ba(FeO2)2与硝酸不发生氧化还原反应,其反应方程式为:Ba(FeO2)2+8HNO3═Ba(NO3)2+2Fe(NO3)3+4H2O,
故答案为:Ba(FeO2)2+8HNO3═Ba(NO3)2+2Fe(NO3)3+4H2O;
(2)入X调节溶液的pH=4~5,则X应能消耗H+,结合工厂主要生产BaCl2、BaCO3、BaSO4的实际情况,可选用BaCO3;离子方程式:BaCO3+2H+═Ba2++H2O+CO2↑,故答案为:BaCO3+2H+═Ba2++H2O+CO2↑;
(3)BaSO3可被硝酸氧化生成硫酸钡,硫酸钡不溶于硝酸,故答案为:BaSO3;
(4)氧化剂的氧化性大于氧化产物的氧化性,Ba2++2NO3-+3SO2+2H2O═BaSO4↓+2NO↑+4H++2SO42-反应中硝酸根是氧化剂,硫酸根是氧化产物,故答案为:强;
(5)根据化合价升降相等,在该反应中,NH4+→NO2-,N的化合价由-3→-+3,升高6价,O2化合价降低4价,化合价变化的最小公倍数为12,则NH4+的计量数为2,O2计量数为3,然后根据电荷守恒配平:2NH4++3O2+4OH-═2NO2-+6H2O,故答案为:2;3;4;2;6;
(6)1mol BaSO3被氧化时,失去2mol电子,则硝酸得到2mo电子,反应中N元素化合价由+5价降低到+2价,设有x mol硝酸被钡还原,则有[5-(+2)]x=2,
x=0.67,故答案为:0.67;
(7)消耗32g(1mol)CH3OH转移6mol电子,由CH3OH中碳原子的化合价升高6,所以反应后碳的化合价为+4,产物为CO2,根据质量守恒和化合价升降总数相等得:5CH3OH+6HNO3═5CO2+3N2+13H2O,反应中氧化剂是硝酸,还原剂是甲醇,参加反应的还原剂和氧化剂的物质的量之比是5:6,
故答案为:5:6;
(8)反应后剩余硝酸的物质的量为0.5×0.1=0.05mol,根据氮原子守恒可知n(HNO3)=n(HNO3)剩余+n(CuNO3)×2+n(NO2+NO)=0.05mol+$\frac{9.6g}{64g/mol}$mol×2+$\frac{2.24L}{22.4L/mol}$=0.45mol,故原有硝酸的物质的量浓度为$\frac{0.45mol}{0.05L}$=9mol/L,故答案为:9mol/L.
点评 本题考查工艺流程和氧化还原反应的计算,为高频考点,侧重于学生的分析能力和计算能力的考查,注意从元素化合价的角度解答该题,难度中等.

| A. | 笨 | B. | 乙醇 | C. | 乙酸乙脂 | D. | 戍烷 |
| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量/mg | 255 | 385 | 459 |
| 生成气体体积/ml | 280 | 336 | 336 |
(2)选择合适数据,可求得的盐酸物质的量浓度是1mol/L.
(3)选择合适数据,可计算出镁铝的物质的量之比为1:1.
(4)丙组实验后,向容器中加入一定量1.00mol•L-lNaOH溶液,恰好使铝元素全部以A1O2-形式存在,并使Mg2+刚好沉淀完全,则溶液中NaCl的物质的量为0.03mol.
| A. | 0.1molHgO与0.3molHg | B. | 0.2molHgO与0.2mol Hg | ||
| C. | 0.4molHgO与0.2mol O2 | D. | 0.4molHgO |
| A. | 金属晶体的一个晶胞中所含的原子数:钾型=镁型<铜型 | |
| B. | 在卤族元素(F、Cl、Br、I)的氢化物中,HCl的沸点最低 | |
| C. | CaH2、Na2O2晶体的阴、阳离子个数比分别为2:1、1:1 | |
| D. | 晶体熔点:金刚石>食盐>冰>干冰 |
| A. | 转移电子的物质的量 | B. | 产生SO2的物质的量 | ||
| C. | 氧化剂的物质的量 | D. | 生成水的物质的量 |
| A. | pH值增大 | B. | 水电离出的c(H+)减小 | ||
| C. | c(OH-)增大 | D. | c(H+)•c(OH-)的值增大 |
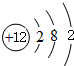 ;画出BC2的电子式
;画出BC2的电子式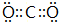 ,结构式O=C=O,其晶体类型为分子晶体
,结构式O=C=O,其晶体类型为分子晶体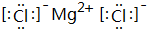 ,其晶体类型为离子晶体.
,其晶体类型为离子晶体.