题目内容
5.25℃时,下列溶液中离子浓度的等量关系正确的是( )| A. | 0.1 mol/L氨水中:c(NH4+)+c(H+)=c(OH-) | |
| B. | 0.1 mol/L的NH4Cl溶液中:c(NH4+)=c(Cl-) | |
| C. | pH=12的NaOH溶液与pH=12的氨水中:c(Na+)=c(NH4+) | |
| D. | pH=3的盐酸和pH=11的氨水等体积混合后:c(OH-)=c(H+) |
分析 A.任何电解质溶液中都存在电荷守恒,根据电荷守恒判断;
B.氯化铵是强酸弱碱盐,其水溶液呈酸性,再结合电荷守恒判断c(NH4+)、c(Cl-)相对大小;
C.一水合氨是弱电解质,pH=12的NaOH和氨水中氢离子浓度相等,温度相同,离子积常数相等,则氢氧根离子浓度相等,根据电荷守恒判断c(Na+)、c(NH4+)相对大小;
D.一水合氨是弱电解质,pH=3的盐酸浓度小于pH=11氨水浓度,二者等体积混合,则氨水有剩余,溶液呈碱性.
解答 解:A.任何电解质溶液中都存在电荷守恒,根据电荷守恒得c(NH4+)+c(H+)=c(OH-),故A正确;
B.氯化铵是强酸弱碱盐,其水溶液呈酸性,则c(H+)>c(OH-),再结合电荷守恒得c(NH4+)<c(Cl-),故B错误;
C.一水合氨是弱电解质,pH=12的NaOH和氨水中氢离子浓度相等,温度相同,离子积常数相等,则氢氧根离子浓度相等,根据电荷守恒得c(Na+)=c(NH4+),故C正确;
D.一水合氨是弱电解质,pH=3的盐酸浓度小于pH=11氨水浓度,二者等体积混合,则氨水有剩余,溶液呈碱性,则c(H+)<c(OH-),故D错误;
故选AC.
点评 本题考查离子浓度大小比较,为高频考点,明确溶液中的溶质及其溶液酸碱性再结合电荷守恒、物料守恒来分析解答即可,易错选项是C.

练习册系列答案
相关题目
9.实验室中需要配制2mol•L-1的NaCl溶液950mL,配制时应选用的容量瓶的规格和称取的NaCl质量分别是( )
| A. | 950 mL,111.2g | B. | 1000 mL,117.0g | C. | 500 mL,117g | D. | 任意规格,111.2g |
10.已知24ml浓度为0.05mol/L的Na2SO3溶液恰好与一定量的浓度为0.1mol/L的Fe2(SO4)3溶液完全反应,已知Fe3+被还原为Fe2+,则需要Fe2(SO4)3溶液体积为( )
| A. | 6mL | B. | 12mL | C. | 24mL | D. | 18mL |
13.下列表示对应化学反应的离子方程式正确的是( )
| A. | 过氧化钠和水反应:Na2O2+H2O═2Na++2OH-+O2↑ | |
| B. | 明矾净水作用:Al3++3H2O?Al(OH)3(胶体)+3H+ | |
| C. | 少量SO2气体通入NaClO溶液中:SO2+H2O+ClO-═SO42-+Cl-+2H+ | |
| D. | 过量的CO2通入NaAlO2溶液中:2AlO2-+CO2+3H2O═Al(OH)3↓+CO32- |
20.下列有关化学用语正确的是( )
| A. | 次氯酸的结构式:H-Cl-O | B. | 钾原子的结构示意图: | ||
| C. | HCN的电子式: | D. | 芒硝的化学式:Na2CO3•10H2O |
17.100℃时,下列各溶液中,离子的物质的量浓度关系正确的是( )
| A. | pH=4的醋酸中:c(H+)=1.0×10-4 mol•L-1 | |
| B. | 饱和小苏打溶液中:c(Na+)=c(HCO3-) | |
| C. | 饱和食盐水中:c(Na+)+c(H+)=c(Cl-)+c(OH-) | |
| D. | pH=12的纯碱溶液中:c(OH-)=1.0×10-2 mol•L-1 |
14.欲将蛋白质从水中析出而又不改变它的性质,应加入的试剂是( )
| A. | 乙酸铅溶液 | B. | 浓硝酸 | C. | 95%酒精 | D. | 饱和(NH4)2SO4溶液 |

 $\stackrel{KMnO_{4}}{→}$
$\stackrel{KMnO_{4}}{→}$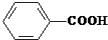

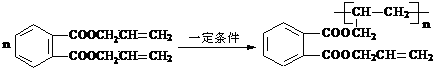
 .
.
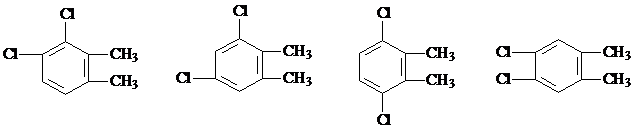 ,其中核磁共振氢谱只有两组峰,且峰面积比为3:1的有2种.
,其中核磁共振氢谱只有两组峰,且峰面积比为3:1的有2种. 二氧化硒(SeO2)是一种氧化剂,其被还原后的单质硒可能成为环境污染物,通过与浓HNO3或H2SO4反应生成SeO2以回收Se.完成下列填空:
二氧化硒(SeO2)是一种氧化剂,其被还原后的单质硒可能成为环境污染物,通过与浓HNO3或H2SO4反应生成SeO2以回收Se.完成下列填空: