题目内容
13.下列表示对应化学反应的离子方程式正确的是( )| A. | 过氧化钠和水反应:Na2O2+H2O═2Na++2OH-+O2↑ | |
| B. | 明矾净水作用:Al3++3H2O?Al(OH)3(胶体)+3H+ | |
| C. | 少量SO2气体通入NaClO溶液中:SO2+H2O+ClO-═SO42-+Cl-+2H+ | |
| D. | 过量的CO2通入NaAlO2溶液中:2AlO2-+CO2+3H2O═Al(OH)3↓+CO32- |
分析 A.电子不守恒;
B.水解生成氢氧化铝胶体可净化水;
C.发生氧化还原反应,遵循电子、电荷守恒;
D.反应生成氢氧化铝、碳酸氢钠.
解答 解:A.过氧化钠和水反应的离子反应为2Na2O2+2H2O═4Na++4OH-+O2↑,故A错误;
B.明矾净水作用的离子反应为Al3++3H2O?Al(OH)3(胶体)+3H+,故B正确;
C.少量SO2气体通入NaClO溶液中的离子反应为SO2+H2O+ClO-═SO42-+Cl-+2H+,故C正确;
D.过量的CO2通入NaAlO2溶液中的离子反应为AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-,故D错误;
故选BC.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重水解反应及氧化还原反应的离子反应考查,题目难度不大.

练习册系列答案
相关题目
17.下列属于酸性食物的是( )
| A. | 海带 | B. | 西瓜 | C. | 苹果 | D. | 猪肉 |
18.下列有关pH变化的判断中,正确的是( )
| A. | 酸雨样品放置一段时间后,pH会增大 | |
| B. | 随着温度的升高,纯水pH增大 | |
| C. | 新制氯水经光照一段时间后,pH减小 | |
| D. | 氢氧化钠溶液久置于空气中,pH增大 |
1.化学与军事密切相关.下列说法正确的是( )
| A. | “歼-20”飞机上使用的碳纤维是一种新型的有机高分子材料 | |
| B. | “辽宁舰”上用于舰载机降落拦阻索的特种钢缆,属于新型无机非金属材料 | |
| C. | 军舰船底镶嵌锌块,锌作正极,以防船体被腐蚀 | |
| D. | 硝化甘油是由甘油(丙三醇)硝化制得,它属于酯类 |
8.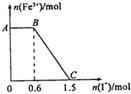 已知酸性K2Cr2O7溶液可与FeSO4反应生成Fe3+和Cr3+.现将硫酸酸化的K2Cr2O7溶液与FeSO4溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如下图所示,下列说法中不正确的是( )
已知酸性K2Cr2O7溶液可与FeSO4反应生成Fe3+和Cr3+.现将硫酸酸化的K2Cr2O7溶液与FeSO4溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如下图所示,下列说法中不正确的是( )
 已知酸性K2Cr2O7溶液可与FeSO4反应生成Fe3+和Cr3+.现将硫酸酸化的K2Cr2O7溶液与FeSO4溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如下图所示,下列说法中不正确的是( )
已知酸性K2Cr2O7溶液可与FeSO4反应生成Fe3+和Cr3+.现将硫酸酸化的K2Cr2O7溶液与FeSO4溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如下图所示,下列说法中不正确的是( )| A. | 图中AB段的氧化剂为K2Cr2O7 | |
| B. | 开始加入的K2Cr2O7为0.25mol | |
| C. | 图中BC段发生的反应为2Fe3++2I-═2Fe2++I2 | |
| D. | K2Cr2O7与FeSO4反应的物质的量之比为1:3 |
5.25℃时,下列溶液中离子浓度的等量关系正确的是( )
| A. | 0.1 mol/L氨水中:c(NH4+)+c(H+)=c(OH-) | |
| B. | 0.1 mol/L的NH4Cl溶液中:c(NH4+)=c(Cl-) | |
| C. | pH=12的NaOH溶液与pH=12的氨水中:c(Na+)=c(NH4+) | |
| D. | pH=3的盐酸和pH=11的氨水等体积混合后:c(OH-)=c(H+) |
2.下列叙述正确的是( )
| A. | 分子晶体中的每个分子内一定含有共价键 | |
| B. | 原子晶体中的相邻原子间可能存在极性共价键 | |
| C. | 离子晶体中可能含有共价键 | |
| D. | 金属晶体的熔点和沸点都很高 |