题目内容
10.已知24ml浓度为0.05mol/L的Na2SO3溶液恰好与一定量的浓度为0.1mol/L的Fe2(SO4)3溶液完全反应,已知Fe3+被还原为Fe2+,则需要Fe2(SO4)3溶液体积为( )| A. | 6mL | B. | 12mL | C. | 24mL | D. | 18mL |
分析 Na2SO3被氧化为Na2SO4,S元素化合价由+4价升高为+6价;Fe2(SO4)3溶液完全反应,Fe3+被还原为Fe2+,根据电子转移守恒计算a的值.
解答 解:n(Na2SO3)=0.024L×0.05mol/L=0.0012mol,反应后被氧化生成Na2SO4,失去0.0024mol电子,
设需要Fe2(SO4)3溶液体积为VL,
则0.1mol/L×V×2×(3-2)=0.0024mol,
V=0.012L=12mL,
故选B.
点评 本题考查氧化还原反应计算、氧化还原反应概念等,难度中等,表示出得失数目是解题关键,熟练掌握电子转移守恒思想的运用.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
20.淀粉溶液是一种胶体,淀粉遇到碘单质可以出现明显的蓝色特征.现将淀粉和NaCl溶液混合,装在半透膜中,浸泡在盛有蒸馏水的烧杯内,过一段时间后,取烧杯中液体进行实验,能证明半透膜完好无损是( )
| A. | 加入单质碘变蓝 | B. | 加入单质碘不变蓝 | ||
| C. | 加入AgNO3溶液没有白色沉淀产生 | D. | 加入AgNO3溶液产生白色沉淀 |
18.下列有关pH变化的判断中,正确的是( )
| A. | 酸雨样品放置一段时间后,pH会增大 | |
| B. | 随着温度的升高,纯水pH增大 | |
| C. | 新制氯水经光照一段时间后,pH减小 | |
| D. | 氢氧化钠溶液久置于空气中,pH增大 |
5.同一系列烷烃,随碳原子数的增加而递减的是( )
| A. | 熔沸点 | B. | 含氢质量分数 | ||
| C. | 液态时密度 | D. | 完全燃烧时耗O2量 |
1.化学与军事密切相关.下列说法正确的是( )
| A. | “歼-20”飞机上使用的碳纤维是一种新型的有机高分子材料 | |
| B. | “辽宁舰”上用于舰载机降落拦阻索的特种钢缆,属于新型无机非金属材料 | |
| C. | 军舰船底镶嵌锌块,锌作正极,以防船体被腐蚀 | |
| D. | 硝化甘油是由甘油(丙三醇)硝化制得,它属于酯类 |
8.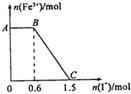 已知酸性K2Cr2O7溶液可与FeSO4反应生成Fe3+和Cr3+.现将硫酸酸化的K2Cr2O7溶液与FeSO4溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如下图所示,下列说法中不正确的是( )
已知酸性K2Cr2O7溶液可与FeSO4反应生成Fe3+和Cr3+.现将硫酸酸化的K2Cr2O7溶液与FeSO4溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如下图所示,下列说法中不正确的是( )
 已知酸性K2Cr2O7溶液可与FeSO4反应生成Fe3+和Cr3+.现将硫酸酸化的K2Cr2O7溶液与FeSO4溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如下图所示,下列说法中不正确的是( )
已知酸性K2Cr2O7溶液可与FeSO4反应生成Fe3+和Cr3+.现将硫酸酸化的K2Cr2O7溶液与FeSO4溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如下图所示,下列说法中不正确的是( )| A. | 图中AB段的氧化剂为K2Cr2O7 | |
| B. | 开始加入的K2Cr2O7为0.25mol | |
| C. | 图中BC段发生的反应为2Fe3++2I-═2Fe2++I2 | |
| D. | K2Cr2O7与FeSO4反应的物质的量之比为1:3 |
5.25℃时,下列溶液中离子浓度的等量关系正确的是( )
| A. | 0.1 mol/L氨水中:c(NH4+)+c(H+)=c(OH-) | |
| B. | 0.1 mol/L的NH4Cl溶液中:c(NH4+)=c(Cl-) | |
| C. | pH=12的NaOH溶液与pH=12的氨水中:c(Na+)=c(NH4+) | |
| D. | pH=3的盐酸和pH=11的氨水等体积混合后:c(OH-)=c(H+) |
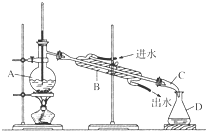 某同学设计了如图所示装置进行石油蒸馏的实验,请回答下列有关问题:
某同学设计了如图所示装置进行石油蒸馏的实验,请回答下列有关问题: