题目内容
17.100℃时,下列各溶液中,离子的物质的量浓度关系正确的是( )| A. | pH=4的醋酸中:c(H+)=1.0×10-4 mol•L-1 | |
| B. | 饱和小苏打溶液中:c(Na+)=c(HCO3-) | |
| C. | 饱和食盐水中:c(Na+)+c(H+)=c(Cl-)+c(OH-) | |
| D. | pH=12的纯碱溶液中:c(OH-)=1.0×10-2 mol•L-1 |
分析 A.pH=4的醋酸中,c(H+)=10-pH;
B.任何电解质溶液中都存在物料守恒,根据物料守恒判断;
C.任何电解质溶液中都存在电荷守恒,根据电荷守恒判断;
D.该温度下纯水pH=6,则水的离子积常数Kw=10-12,c(OH-)=$\frac{{K}_{W}}{c({H}^{+})}$.
解答 解:A.pH=4的醋酸中,c(H+)=10-pH=1.0×10-4 mol•L-1,故A正确;
B.任何电解质溶液中都存在物料守恒,根据物料守恒得c(Na+)=c(HCO3-)+c(H2CO3)+c(CO32-),故B错误;
C.任何电解质溶液中都存在电荷守恒,根据电荷守恒得c(Na+)+c(H+)=c(Cl-)+c(OH-),故C正确;
D.该温度下纯水pH=6,则水的离子积常数Kw=10-12,c(OH-)=$\frac{{K}_{W}}{c({H}^{+})}$=$\frac{1{0}^{-12}}{1{0}^{-12}}$mol/L=1mol/L,故D错误;
故选AC.
点评 本题考查离子浓度大小比较及pH有关计算,为高频考点,明确溶液中的溶质再结合电荷守恒及物料守恒分析解答,注意该温度下水的离子积常数变化,为易错点.

练习册系列答案
相关题目
8.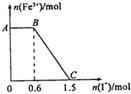 已知酸性K2Cr2O7溶液可与FeSO4反应生成Fe3+和Cr3+.现将硫酸酸化的K2Cr2O7溶液与FeSO4溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如下图所示,下列说法中不正确的是( )
已知酸性K2Cr2O7溶液可与FeSO4反应生成Fe3+和Cr3+.现将硫酸酸化的K2Cr2O7溶液与FeSO4溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如下图所示,下列说法中不正确的是( )
 已知酸性K2Cr2O7溶液可与FeSO4反应生成Fe3+和Cr3+.现将硫酸酸化的K2Cr2O7溶液与FeSO4溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如下图所示,下列说法中不正确的是( )
已知酸性K2Cr2O7溶液可与FeSO4反应生成Fe3+和Cr3+.现将硫酸酸化的K2Cr2O7溶液与FeSO4溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如下图所示,下列说法中不正确的是( )| A. | 图中AB段的氧化剂为K2Cr2O7 | |
| B. | 开始加入的K2Cr2O7为0.25mol | |
| C. | 图中BC段发生的反应为2Fe3++2I-═2Fe2++I2 | |
| D. | K2Cr2O7与FeSO4反应的物质的量之比为1:3 |
5.25℃时,下列溶液中离子浓度的等量关系正确的是( )
| A. | 0.1 mol/L氨水中:c(NH4+)+c(H+)=c(OH-) | |
| B. | 0.1 mol/L的NH4Cl溶液中:c(NH4+)=c(Cl-) | |
| C. | pH=12的NaOH溶液与pH=12的氨水中:c(Na+)=c(NH4+) | |
| D. | pH=3的盐酸和pH=11的氨水等体积混合后:c(OH-)=c(H+) |
12.将盛有NH4HCO3粉末的小烧杯放入盛有少量醋酸的大烧杯中.然后向小烧杯中加入盐酸,反应剧烈,醋酸逐渐凝固.由此可见( )
| A. | NH4HCO3和盐酸的反应是放热反应 | |
| B. | 该反应中,热能转化为产物内部的能量 | |
| C. | 反应物的总能量高于生成物的总能量 | |
| D. | 反应的热化学方程式为:NH4HCO3+HCl═NH4Cl+CO2↑+H2O△H>0 |
2.下列叙述正确的是( )
| A. | 分子晶体中的每个分子内一定含有共价键 | |
| B. | 原子晶体中的相邻原子间可能存在极性共价键 | |
| C. | 离子晶体中可能含有共价键 | |
| D. | 金属晶体的熔点和沸点都很高 |
9.下列离子方程式正确的是( )
| A. | 氯气和水的反应 Cl2+H2O═2H++Cl-+ClO- | |
| B. | 碳酸氢钠水解 HCO3-+H2O═H3O++CO32- | |
| C. | 碳酸钠水解 CO32-+2H2O═H2CO3+2OH- | |
| D. | 亚硫酸氢钠与过量的Ba(OH)2溶液 HSO3-+Ba2++OH-═BaSO3↓+H2O |
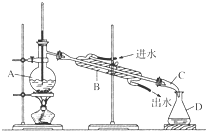 某同学设计了如图所示装置进行石油蒸馏的实验,请回答下列有关问题:
某同学设计了如图所示装置进行石油蒸馏的实验,请回答下列有关问题: