题目内容
14.下列实验操作中正确的是( )| A. | 将溴水、铁粉和苯混合加热即可制得溴苯 | |
| B. | 除去溴苯中红棕色的溴,可用稀NaOH溶液反复洗涤,再用分液漏斗分液 | |
| C. | 用苯和浓HNO3、浓H2SO4反应制取硝基苯时需水浴加热,温度计应放在反应混合液中 | |
| D. | 制取硝基苯时,应先向试管中加入浓H2SO4 2 mL,再加入1.5 mL浓HNO3,再滴入苯约1 mL,然后放在水浴中加热 |
分析 A、苯与纯溴反应;
B、溴与氢氧化钠溶液反应,溴苯与氢氧化钠溶液不反应;
C、制取硝基苯,测量热水的温度;
D、根据浓硫酸的稀释进行分析加入试剂的先后顺序.
解答 解:A、苯与纯溴在铁粉作催化剂的条件下,反应制取溴苯,故A错误;
B、由于溴苯与氢氧化钠溶液不发生反应,而与溴能够发生反应,反应后混合液分层,所以可用稀NaOH溶液反复洗涤,并用分液漏斗分液,故B正确;
C、用苯和浓HNO3、浓H2SO4反应制取硝基苯时需水浴加热,需要测量水的温度,温度计应放在热水中,故C错误;
D、应该先加入苯,再加入浓硫酸,滴加顺序颠倒,容易发生危险,故D错误;
故选B.
点评 本题考查了化学实验基本操作方面的知识,涉及了除杂、加入试剂顺序、气体的检验方法等知识,可以根据所学知识完成,本题难度中等.

练习册系列答案
 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案
相关题目
4.运用元素周期律分析下面的推断,其中错误的是( )
| A. | 已知Ra是第七周期、IIA族的元素,故Ra(OH)2的碱性比Mg(OH)2的碱性强 | |
| B. | 已知As是第四周期、VA族的元素,故AsH3 的稳定性比NH3的稳定性强 | |
| C. | 已知Cs原子半径比Na的原子半径大,故Cs与水反应比Na与比反应更剧烈 | |
| D. | 已知Cl与Al处于同一周期,且Cl的核电荷数比Al的核电荷数大,故Cl的原子半径比Al的原子半径小 |
9.X和Y元素的原子,在化学反应中都容易失去电子而形成与Ne相同的电子层结构,已知X的原子序数比Y的原子序数大,下列说法中正确的是( )
| A. | X的金属性比Y的金属性强 | |
| B. | 常温下,X和Y都不能从水中置换出氢 | |
| C. | Y元素的氢氧化物碱性比X元素的氢氧化物碱性大 | |
| D. | X元素的最高化合价比Y元素的最高化合价低 |
19.下列物质沸点最低的是( )
| A. | 庚烷 | B. | 新戊烷 | C. | 正戊烷 | D. | 2-甲基丁烷 |
2.某学生在配制一定物质的量浓度氢氧化钠时,结果所配溶液浓度偏高,其原因可能是( )
| A. | 所用氢氧化钠已经潮解 | |
| B. | 向容量瓶中加水未到刻度线 | |
| C. | 有少量氢氧化钠溶液残留在烧杯里 | |
| D. | 用带游码的托盘天平称2.4 gNaOH时误用了“左码右物”方法 |
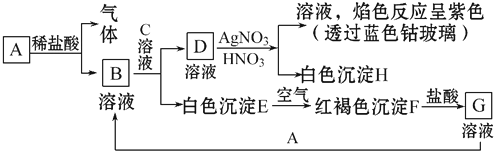
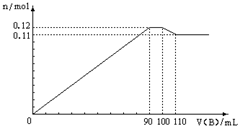 向100mLBaCl2、AlCl3、FeCl3的混合溶液A中,逐滴加入Na2SO4和NaOH的混合溶液B,产生的沉淀和加入混合溶液B的体积关系如下图所示:
向100mLBaCl2、AlCl3、FeCl3的混合溶液A中,逐滴加入Na2SO4和NaOH的混合溶液B,产生的沉淀和加入混合溶液B的体积关系如下图所示: