题目内容
6.写出下列物质间转化的化学化学方程式,并注明反应条件.
分析 ①溴乙烷在NaOH水溶液中水解生成乙醇;
②乙醇与浓硫酸混合加热到170℃发生消去反应生成乙烯;
③乙烯含有不饱和C=C双键,能与溴化氢发生加成反应生成溴乙烷;
④乙烯含有不饱和C=C双键,能与水发生加成反应生成乙醇;
⑤溴乙烷和氢氧化钠醇溶液中共热生成乙烯、溴化钠和水;
⑥乙醇催化氧化生成乙醛和水.
解答 解:①溴乙烷在NaOH水溶液中水解生成乙醇,反应的方程式为CH3CH2Br+NaOH$→_{△}^{H_{2}O}$CH3CH2OH+NaBr,故答案为:CH3CH2Br+NaOH$→_{△}^{H_{2}O}$CH3CH2OH+NaBr;
②乙醇与浓硫酸混合加热到170℃发生消去反应生成乙烯,反应的化学方程式为:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O;故答案为:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O;
③乙烯含有不饱和C=C双键,能与溴化氢发生加成反应生成溴乙烷,反应的化学方程式为:CH2=CH2+HBr$\stackrel{催化剂}{→}$CH3CH2Br;
故答案为:CH2=CH2+HBr$\stackrel{催化剂}{→}$CH3CH2Br;
④乙烯含有不饱和C=C双键,能够在催化剂存在条件下与水发生加成反应生成乙醇,反应的化学方程式为:CH2=CH2+H2O$\stackrel{催化剂}{→}$CH3CH2OH;
故答案为:CH2=CH2+H2O$\stackrel{催化剂}{→}$CH3CH2OH;
⑤溴乙烷和氢氧化钠醇溶液中共热生成乙烯、溴化钠和水,反应的化学方程式为:CH3CH2Br+NaOH$→_{△}^{乙醇}$CH2=CH2↑+NaBr+H2O;
故答案为:CH3CH2Br+NaOH$→_{△}^{乙醇}$CH2=CH2↑+NaBr+H2O;
⑥乙醇能发生催化氧化生成乙醛和水,反应的化学方程式为:2C2H5OH+O2$→_{△}^{铜或银}$2CH3CHO+2H2O;
故答案为:2C2H5OH+O2$→_{△}^{铜或银}$2CH3CHO+2H2O.
点评 本题考查了有机反应方程式的书写,题目难度中等,注意掌握常见有机物结构与性质,根据反应原理找出正确的反应物、生成物、反应条件为解答关键.

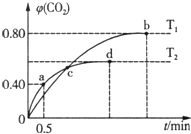 利用I2O5消除CO污染的反应为:5CO(g)+I2O5(s)?5CO2(g)+I2(s),不同温度下,向装有足量I2O5固体的2L恒容密闭容器中通入4mol CO,测得CO2的体积分数随时间t变化曲线如图.下列说法不正确的是( )
利用I2O5消除CO污染的反应为:5CO(g)+I2O5(s)?5CO2(g)+I2(s),不同温度下,向装有足量I2O5固体的2L恒容密闭容器中通入4mol CO,测得CO2的体积分数随时间t变化曲线如图.下列说法不正确的是( )| A. | T2时,0~0.5 min内的反应速率v(CO)=1.6mol/(L•min) | |
| B. | 两种温度下,c点时体系中混合气体的压强相等 | |
| C. | d点时,增大体系压强,CO的转化率不变 | |
| D. | b点和d点时化学平衡常数的大小关系:Kb>Kd |
| A. | 具有同质量、不同体积的N2O和CO2 | B. | 具有同温度、同体积的CO和N2 | ||
| C. | 具有同体积、同密度的SO2和NO2 | D. | 具有同密度、不同质量的O2和O3 |
| A. | 将溴水、铁粉和苯混合加热即可制得溴苯 | |
| B. | 除去溴苯中红棕色的溴,可用稀NaOH溶液反复洗涤,再用分液漏斗分液 | |
| C. | 用苯和浓HNO3、浓H2SO4反应制取硝基苯时需水浴加热,温度计应放在反应混合液中 | |
| D. | 制取硝基苯时,应先向试管中加入浓H2SO4 2 mL,再加入1.5 mL浓HNO3,再滴入苯约1 mL,然后放在水浴中加热 |

| A. | 与金属钠反应时键①断裂 | |
| B. | 与乙酸发生酯化反应时键①断裂 | |
| C. | 与浓硫酸共热到170℃时键③、④断裂 | |
| D. | 在铜催化下与氧气反应时键①、③断裂 |
| A. | ${\;}_{94}^{214}$Pu位于周期表中第六周期 | |
| B. | ${\;}_{53}^{131}$ I与${\;}_{53}^{125}$I性质完全相同 | |
| C. | ${\;}_{53}^{131}$I与${\;}_{53}^{125}$I 互为同位素 | |
| D. | ${\;}_{53}^{131}$I的质子数为78 |
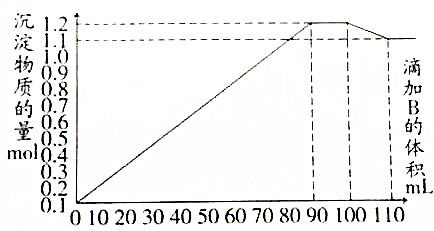
| A. | 加入90mL B时,A溶液中金属离子沉淀完全 | |
| B. | 加入110mL B时,沉淀物仅为BaSO4 | |
| C. | B溶液中Na2SO4和NaOH的物质的量浓度之比为1:1 | |
| D. | 当溶液中含有NaAlO2时,加入溶液B的体积V(B)≥100mL |
 A~G为原子序数依次增大的短周期主族元素,A原子与其他元素不处于同一周期,元素B的基态原子核外电子共有6种运动状态,D、F同族,D原子的基态原子价电子排布式均为ns2npn+2,E元素所在周期中,E气态基态原子的第一电离能力最小,试回答下列问题:(均用元素符号表示).
A~G为原子序数依次增大的短周期主族元素,A原子与其他元素不处于同一周期,元素B的基态原子核外电子共有6种运动状态,D、F同族,D原子的基态原子价电子排布式均为ns2npn+2,E元素所在周期中,E气态基态原子的第一电离能力最小,试回答下列问题:(均用元素符号表示). (Ⅰ)磷是生物体中不可缺少的元素之一,在自然界中磷总是以磷酸盐的形式出现的,例如磷酸钙矿Ca3(PO4)2、磷灰石Ca5F(PO4)3等.
(Ⅰ)磷是生物体中不可缺少的元素之一,在自然界中磷总是以磷酸盐的形式出现的,例如磷酸钙矿Ca3(PO4)2、磷灰石Ca5F(PO4)3等. .
.