题目内容
3.在5NH4NO3═2HNO3+4N2+9H2O反应中,每生成28g N2时,转移的电子数是3.75mol.分析 反应中部分硝酸根中N元素由+5价降低为氮气中0价,铵根中N元素-3价升高为氮气中0价,氮气既是还原产物又是氧化产物,由氮原子守恒,结合方程式可知,还原产物与氧化产物物质的量之比为3:5,根据n=$\frac{m}{M}$计算氮气物质的量,再计算氧化产物物质的量,再结合铵根中N元素化合价变化计算转移电子物质的量.
解答 解:反应中部分硝酸根中N元素由+5价降低为氮气中0价,铵根中N元素-3价升高为氮气中0价,氮气既是还原产物又是氧化产物,由氮原子守恒,结合方程式可知,还原产物与氧化产物物质的量之比为3:5,生成氮气物质的量为$\frac{28g}{28g/mol}$=1mol,故氧化产物的物质的量为1mol×$\frac{5}{8}$=$\frac{5}{8}$mol,铵根中N元素被氧化,故转移电子为$\frac{5}{8}$mol×2×[0-(-3)]=3.75mol,
故答案为:3.75.
点评 本题考查氧化还原反应计算,关键是判断反应中N元素化合价变化,难度不大.

练习册系列答案
相关题目
13.下列离子方程式书写正确的是( )
| A. | 澄清石灰水中通入过量二氧化碳:Ca2++2OH-+CO2=CaCO3↓+H2O | |
| B. | 过量的氨水滴加到氯化铝溶液:Al3++4OH-═AlO2-+2H2O | |
| C. | 氧化亚铁溶于稀盐酸:FeO+2H+=Fe2++H2O | |
| D. | 氢氧化钡溶液中加过量小苏打:Ba2++OH-+HCO3-=BaCO3↓+H2O. |
14.下列实验操作中正确的是( )
| A. | 将溴水、铁粉和苯混合加热即可制得溴苯 | |
| B. | 除去溴苯中红棕色的溴,可用稀NaOH溶液反复洗涤,再用分液漏斗分液 | |
| C. | 用苯和浓HNO3、浓H2SO4反应制取硝基苯时需水浴加热,温度计应放在反应混合液中 | |
| D. | 制取硝基苯时,应先向试管中加入浓H2SO4 2 mL,再加入1.5 mL浓HNO3,再滴入苯约1 mL,然后放在水浴中加热 |
11.下列说法正确的是( )
| A. | ${\;}_{94}^{214}$Pu位于周期表中第六周期 | |
| B. | ${\;}_{53}^{131}$ I与${\;}_{53}^{125}$I性质完全相同 | |
| C. | ${\;}_{53}^{131}$I与${\;}_{53}^{125}$I 互为同位素 | |
| D. | ${\;}_{53}^{131}$I的质子数为78 |
15.向a mol BaCl2、AlCl3和FeCl3的混合液A中,逐滴加入Na2SO4和NaOH的混合液B,产生沉淀的物质的量n与加入溶液B的体积关系如图所示,下列叙述正确的是( )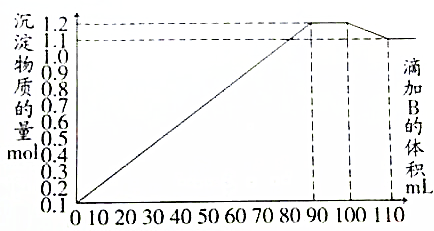

| A. | 加入90mL B时,A溶液中金属离子沉淀完全 | |
| B. | 加入110mL B时,沉淀物仅为BaSO4 | |
| C. | B溶液中Na2SO4和NaOH的物质的量浓度之比为1:1 | |
| D. | 当溶液中含有NaAlO2时,加入溶液B的体积V(B)≥100mL |
10. 节能减排是当下环境保护的重点.
节能减排是当下环境保护的重点.
(1)将CO和气态水通入一个体积固定的密闭容器中,在一定条件下发生如下可逆反应:CO(g)+H2O(g)?CO2(g)+H2(g),△H<0,800℃,在2L恒容密闭容器中,起始时按照下表数据进行投料,达到平衡状态,K=l.0.
①从起始经过5min达到化学平衡时,用生成物CO2表示该反应的反应速率v(CO2)=0.01mol/(L.min);平衡时,容器中CO的转化率为50%.
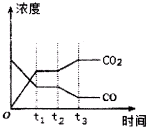
②如图表示上述反应在tl时刻达到平衡,在t2时刻因改变某个条件而发生变化的情况.则t2时刻发生改变的条件可能是降低温度或降低H2浓度或增大H2O(g)浓度.(写出一条)
(2)汽车尾气中的一氧化碳是大气污染物,可通过反应:CO(g)+$\frac{1}{2}$O2(g)?CO2(g)降低其浓度.
①某温度下,在两个容器中进行上述反应,容器中各物质的起始浓度及正逆反应速率关系如下表所示.请在表中的空格处填写“>““<”或“=“.
②相同温度下,某汽车尾气中CO、CO2的浓度分别为l.0×10-5mol/L和1.0×l0-4mol/L.若在汽车的排气管上增加一个补燃器,不断补充O2并使其浓度保持为1.0×l0-4mol/L,则最终尾气中CO的浓度为1.1×10-6mol/L(请保留两位有效数字).
(3)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其KSp=2.8×l0-9.现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×l0-4mol/L,则生成CaCO3沉淀所需CaCl2溶液的最小浓度为5.6×10-5mol/L.
 节能减排是当下环境保护的重点.
节能减排是当下环境保护的重点.(1)将CO和气态水通入一个体积固定的密闭容器中,在一定条件下发生如下可逆反应:CO(g)+H2O(g)?CO2(g)+H2(g),△H<0,800℃,在2L恒容密闭容器中,起始时按照下表数据进行投料,达到平衡状态,K=l.0.
| H2O | CO | CO2 | H2 | |
| n/mol | 0.20 | 0.20 | 0 | 0 |
②如图表示上述反应在tl时刻达到平衡,在t2时刻因改变某个条件而发生变化的情况.则t2时刻发生改变的条件可能是降低温度或降低H2浓度或增大H2O(g)浓度.(写出一条)
(2)汽车尾气中的一氧化碳是大气污染物,可通过反应:CO(g)+$\frac{1}{2}$O2(g)?CO2(g)降低其浓度.
①某温度下,在两个容器中进行上述反应,容器中各物质的起始浓度及正逆反应速率关系如下表所示.请在表中的空格处填写“>““<”或“=“.
| 容器编号 | c(CO)/mol•L-1 | c(O2))/mol•L-1 | c(CO2))/mol•L-1 | v(正)和v(逆)比较 |
| Ⅰ | 2.0×10-4 | 4.0×10-4 | 4.0×10-2 | v(正)=v(逆) |
| Ⅱ | 3.0×10-4 | 4.0×10-4 | 5.0×10-2 | v(正)>v(逆) |
(3)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其KSp=2.8×l0-9.现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×l0-4mol/L,则生成CaCO3沉淀所需CaCl2溶液的最小浓度为5.6×10-5mol/L.
11.某非金属元素X的最高化合价为+m,其最高价氧化物的水化物的分子中有b个氧原子,则该元素最高价氧化物的水化物的分子式为( )
| A. | Hm+2bXOb | B. | Hm-2bXOb | C. | Hb+mXOb | D. | H2b-mXOb |
 A~G为原子序数依次增大的短周期主族元素,A原子与其他元素不处于同一周期,元素B的基态原子核外电子共有6种运动状态,D、F同族,D原子的基态原子价电子排布式均为ns2npn+2,E元素所在周期中,E气态基态原子的第一电离能力最小,试回答下列问题:(均用元素符号表示).
A~G为原子序数依次增大的短周期主族元素,A原子与其他元素不处于同一周期,元素B的基态原子核外电子共有6种运动状态,D、F同族,D原子的基态原子价电子排布式均为ns2npn+2,E元素所在周期中,E气态基态原子的第一电离能力最小,试回答下列问题:(均用元素符号表示).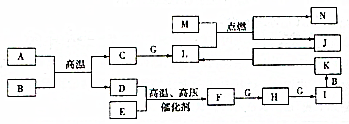 已知A、B、C、F、H、I、K、L、N是化合物,且A、B、F分子中电子数相等,D、E、G、J、M为单质,M为金属,J为黑色粉末,各物质转化关系如图所示,请回答:
已知A、B、C、F、H、I、K、L、N是化合物,且A、B、F分子中电子数相等,D、E、G、J、M为单质,M为金属,J为黑色粉末,各物质转化关系如图所示,请回答: