题目内容
20.固体乙醇晶体中不存在的作用力是( )| A. | 氢键 | B. | 极性键 | C. | 非极性键 | D. | 离子键 |
分析 固体乙醇为分子晶体,分子晶体中的作用力为分子间作用力,乙醇中含有C-C键、C-O键、O-H键、C-H键,以此来解答.
解答 解:A.乙醇中含有O元素及O-H键,存在氢键,故A不选;
B.乙醇中C-O键、O-H键、C-H键,均为极性键,故B不选;
C.乙醇中含有C-C键,为非极性键,故C不选;
D.乙醇为共价化合物,不存在离子键,故D选.
故选D.
点评 本题考查化学键,明确元素之间的化学键是解答本题的关键,注意分子晶体中存在分子间作用力及乙醇中的氢键即可解答,选项A为解答的难点,题目难度不大.

练习册系列答案
相关题目
12.氯酸是一种强酸,常温下浓度超过40%时会发生分解,反应可表示为:aHClO3→bO2↑+cCl2↑+dHClO4+eH2O,用湿润的淀粉碘化钾试纸检验气体产物时,试纸先变蓝后褪色.下列说法正确的是( )
| A. | 由反应可知化学计量数存在如下关系:2b=5c+d | |
| B. | 若化学计量数a=8,b=3,则电子数转移为20e- | |
| C. | 若氯酸分解所得的lmol混合气体质量为47.6g,则反应方程式可表示为:26HClO3→15O2↑+8C12↑+10HClO4+8H2O | |
| D. | 变蓝的淀粉碘化钾试纸褪色是因为漂白 |
13.以NA表示阿佛加德罗常数,下列说法中正确的是( )
| A. | 8gCH 4中含有的共价键总数为NA | |
| B. | 3.2g的Cu与足量的浓HNO3反应生成的气体分子数为NA | |
| C. | 含有NA个中子的D2O的质量为2.0g | |
| D. | PH=2的硫酸氢钠溶液中的硫酸根离子数为0.01NA |
10.下列指定反应的离子方程式正确的是( )
| A. | FeCl3溶液滴入热水中制Fe(OH)3胶体:Fe3++3OH-═Fe(OH)3(胶体) | |
| B. | ICl溶于冷的稀KOH溶液中:ICl+2OH-═Cl-+IO-+H2O | |
| C. | 用惰性电极电解CuSO4溶液:2Cu2++4OH-$\frac{\underline{\;电解\;}}{\;}$2Cu↓+O2↑+2H2O | |
| D. | Ca(HCO3)2溶液与过量NaOH溶液反应:HC${{O}_{3}}^{-}$+Ca2++OH-═CaCO3↓+H2O |
16.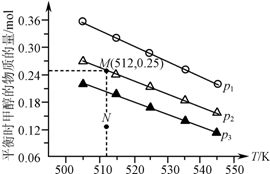 在1.0L恒容密闭容器中投入1mol CO2和2.75mol H2发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图所示.下列说法正确的是( )
在1.0L恒容密闭容器中投入1mol CO2和2.75mol H2发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图所示.下列说法正确的是( )
 在1.0L恒容密闭容器中投入1mol CO2和2.75mol H2发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图所示.下列说法正确的是( )
在1.0L恒容密闭容器中投入1mol CO2和2.75mol H2发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图所示.下列说法正确的是( )| A. | 该反应的正反应为放热反应 | |
| B. | 压强大小关系为p1<p2<p3 | |
| C. | M点对应的平衡常数K的值约为1.04×10-2 | |
| D. | 在p2及512 K时,图中N点v(正)<v(逆) |
11.下列实验方案中,不能达到实验目的是( )
| 选项 | 实验目的 | 实验方案 |
| A | 检验淀粉是否水解生成葡萄糖 | 向淀粉溶液中加入稀H2SO4,加热几分钟,冷却后水解液用NaOH溶液中和,然后再加入新制Cu(OH)2浊液,加热,观察是否有红色沉淀生成 |
| B | 检验Fe(NO3)2晶体是否已氧化变质 | 将Fe(NO3)2样品溶于稀硫酸后,滴加KSCN溶液,观察溶液是否变红 |
| C | 验证Br2的氧化性强于I2 | 将少量溴水加入KI溶液中,再加入CCl4,振荡,静置,可观察到下层液体呈紫色 |
| D | 验证Fe(OH)3的溶解度小于Mg(OH)2 | 将FeCl3溶液加入Mg(OH)2悬浊液中,振荡,可观察到沉淀由白色变为红褐色 |
| A. | A | B. | B | C. | C | D. | D |
8.下列组合判断正确的是( )
①Cl2具有很强的氧化性,在化学反应中只能作氧化剂
②浓H2SO4有强氧化性,常温下能与Cu发生剧烈反应
③化合反应均为氧化还原反应
④Cl2、SO2均能使品红溶液褪色,说明二者均有氧化性
⑤2Na2O2+2H2O=4NaOH+O2↑;Cl2+H2O=HCl+HClO 这两个反应中水均作还原剂.
①Cl2具有很强的氧化性,在化学反应中只能作氧化剂
②浓H2SO4有强氧化性,常温下能与Cu发生剧烈反应
③化合反应均为氧化还原反应
④Cl2、SO2均能使品红溶液褪色,说明二者均有氧化性
⑤2Na2O2+2H2O=4NaOH+O2↑;Cl2+H2O=HCl+HClO 这两个反应中水均作还原剂.
| A. | ①②不正确,③④⑤正确 | B. | ①②③④⑤均不正确 | ||
| C. | ①②正确,③④⑤不正确 | D. | ①②③④正确 |
9.氯气常用于饮用水杀菌消毒,已知HClO杀菌能力比ClO-强,经测定25℃,pH=7.5时c(HClO)=c(ClO-),下列有关说法不正确的是( )
| A. | 新制的氯水中存在c(H+)>c(Cl-)=c(HClO)+c(ClO-) | |
| B. | 25℃时,H++ClO-?HClO的平衡常数K=1.0×10-7.5 | |
| C. | 氯气处理饮用水时,pH=5.5的效果比pH=7.5的好 | |
| D. | 新制的氯水中存在c(H+)═c(Cl-)+c(ClO-)+c(OH-) |