题目内容
13.以NA表示阿佛加德罗常数,下列说法中正确的是( )| A. | 8gCH 4中含有的共价键总数为NA | |
| B. | 3.2g的Cu与足量的浓HNO3反应生成的气体分子数为NA | |
| C. | 含有NA个中子的D2O的质量为2.0g | |
| D. | PH=2的硫酸氢钠溶液中的硫酸根离子数为0.01NA |
分析 A、求出甲烷的物质的量,然后根据1mol甲烷中含4mol共价键来分析;
B、二氧化氮与四氧化二氮存在转化平衡,部分二氧化氮转化成四氧化二氮;
C、重水的摩尔质量为20g/mol,重水中含有10个电子,含有NA个中子的D2O的物质的量为0.1mol,质量为2.0g;
D、溶液体积不明确.
解答 解:A.8g甲烷的物质的量为0.5mol,0.5mol甲烷中含有2mol碳氢共价键,含有的共价键数为2NA个,故A错误;
B.3.2g铜的物质的量为0.05mol,0.05mol铜与足量硝酸反应失去0.1mol电子,根据电子守恒,能够生成0.1mol二氧化氮;由于二氧化氮与四氧化二氮存在转化平衡,所以反应生成的气体分子的物质的量小于0.1mol,气体分子数小于0.1NA,故B错误;
C.含有NA个中子的D2O的物质的量为0.1mol,0.1mol重水的质量为2.0g,故C正确;
D、溶液体积不明确,故溶液中硫酸根离子的个数无法计算,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案
相关题目
4.设NA表示阿伏加德罗常数,下列叙述正确的是( )
| A. | 一定条件下6.4g SO2与足量氧气反应生成SO3,转移电子数为0.2 NA | |
| B. | 1 mol AlCl3在熔融状态时离子总数为0.4NA | |
| C. | 标况下,11.2 L氯气完全溶于1 L水中,所得溶液中Cl-和ClO-两种粒子数之和为NA | |
| D. | 6.4 g由S2、S4、S8组成的混合物含硫原子数为0.2 NA |
1.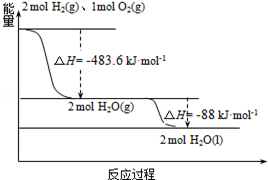 俄罗斯用“质子-M”号运载火箭成功将“光线”号卫星送入预定轨道.发射用的运载火箭使用的是以液氢为燃烧剂,液氧为氧化剂的高能低温推进剂,已知:
俄罗斯用“质子-M”号运载火箭成功将“光线”号卫星送入预定轨道.发射用的运载火箭使用的是以液氢为燃烧剂,液氧为氧化剂的高能低温推进剂,已知:
(1)H2(g)=H2(l)△H1=-0.92kJ•mol-1
(2)O2(g)=O2(l)△H2=-6.84kJ•mol-1
(3)如图:下列说法正确的是( )
 俄罗斯用“质子-M”号运载火箭成功将“光线”号卫星送入预定轨道.发射用的运载火箭使用的是以液氢为燃烧剂,液氧为氧化剂的高能低温推进剂,已知:
俄罗斯用“质子-M”号运载火箭成功将“光线”号卫星送入预定轨道.发射用的运载火箭使用的是以液氢为燃烧剂,液氧为氧化剂的高能低温推进剂,已知:(1)H2(g)=H2(l)△H1=-0.92kJ•mol-1
(2)O2(g)=O2(l)△H2=-6.84kJ•mol-1
(3)如图:下列说法正确的是( )
| A. | 2mol H2(g)与1mol O2(g)所具有的总能量比2molH2O(g)所具有的总能量低 | |
| B. | 氢气的燃烧热为△H=-241.8 kJ•mol-1 | |
| C. | 火箭中液氢燃烧的热化学方程式为:2H2(l)+O2(l)═2H2O(g)△H=-474.92kJ•mol-1 | |
| D. | H2O(g)变成H2O(l)的过程中,断键吸收的能量小于成键放出的能量 |
18.有关化学用语正确的是( )
| A. | Be原子的结构示意图: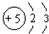 | |
| B. | 二氧化硅的分子式:SiO2 | |
| C. | 质子数为53、中子数为78的碘原子可表示为:53131I | |
| D. | 乙烯的结构式:CH2=CH2 |
5.下列关于化学用语的表示正确的是( )
| A. | 水合氢离子的电子式: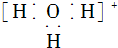 | B. | 氯离子的结构示意图: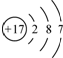 | ||
| C. | 中子数为28的钙原子:2028Ca | D. | 聚丙烯的结构简式: |
20.固体乙醇晶体中不存在的作用力是( )
| A. | 氢键 | B. | 极性键 | C. | 非极性键 | D. | 离子键 |
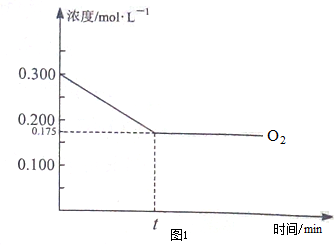
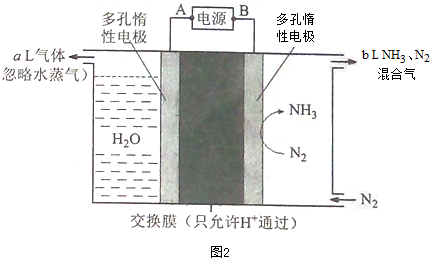

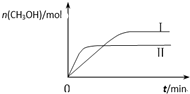 研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义.
研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义.