题目内容
9.氯气常用于饮用水杀菌消毒,已知HClO杀菌能力比ClO-强,经测定25℃,pH=7.5时c(HClO)=c(ClO-),下列有关说法不正确的是( )| A. | 新制的氯水中存在c(H+)>c(Cl-)=c(HClO)+c(ClO-) | |
| B. | 25℃时,H++ClO-?HClO的平衡常数K=1.0×10-7.5 | |
| C. | 氯气处理饮用水时,pH=5.5的效果比pH=7.5的好 | |
| D. | 新制的氯水中存在c(H+)═c(Cl-)+c(ClO-)+c(OH-) |
分析 A.根据反应Cl2(aq)+H2O?HClO+H++Cl-及物料守恒判断;
B.pH=7.5时c(HClO)=c(ClO-),此时氢离子浓度为1×10,7.5mol/L,结合平衡常数的表达式进行计算;
C.pH=5.5时次氯酸的浓度大于次氯酸根离子,则溶液氧化性更强;
D.根据溶液中的电荷守恒判断.
解答 解:A.新制的氯水中存在反应:Cl2(aq)+H2O?HClO+H++Cl-,反应中生成的氯离子与次氯酸的物质的量相等,结合物料守恒可得:c(Cl-)=c(HClO)+c(ClO-),由于氢离子来自氯化氢、次氯酸及水的电离,则溶液中氢离子浓度最大,所以溶液中离子浓度大小为:c(H+)>c(Cl-)=c(HClO)+c(ClO-),故A正确;
B.pH=7.5时c(HClO)=c(ClO-),此时氢离子浓度为:c(H+)=1×10,7.5mol/L,则25℃时H++ClO-?HClO的平衡常数K=$\frac{c(HClO)}{c({H}^{+})•c(Cl{O}^{-})}$=$\frac{1}{c({H}^{+})}$≈3.16×107,故B错误;
C.pH=7.5时c(HClO)=c(ClO-),则pH=5.5时c(HClO)>c(ClO-),溶液中次氯酸浓度越大,氧化效果越好,故C正确;
D.新制的氯水中存在电荷守恒:c(H+)═c(Cl-)+c(ClO-)+c(OH-),故D正确;
故选B.
点评 本题考查离子浓度大小比较,题目难度中等,涉及平衡常数的计算、离子浓度大小比较、盐的水解原理等知识,明确物料守恒、电荷守恒为解答关键,试题侧重考查学生的分析能力及灵活应用基础知识的能力.

练习册系列答案
相关题目
20.固体乙醇晶体中不存在的作用力是( )
| A. | 氢键 | B. | 极性键 | C. | 非极性键 | D. | 离子键 |
14.下列实验现象和原因都正确且有因果关系的是( )
| 选项 | 实验操作及现象 | 产生现象的原因 |
| A | 在氯化银浊液中滴加几滴稀KI溶液,白色沉淀变黄色 | 氯化银的溶度积小于碘化银的溶度积 |
| B | 在新制的氯水中滴加紫色石蕊溶液,溶液先变红色后褪色 | 氯水中有次氯酸,先电离出H+,使石蕊变红;后氧化有色物质 |
| C | 氨气通入酚酞溶液中,溶液变红色 | 氨气是一种碱,在水中电离出OH- |
| D | 借助导线,铜片和锌片在稀硫酸中构成原电池的两个电极,铜极表面产生气泡,锌极溶解 | 锌比铜活泼,锌失去电子,电子经外电路流向铜片,氢离子从铜片获得电子,最终产生氢气 |
| A. | A | B. | B | C. | C | D. | D |
1.下列有关化学用语使用正确的是( )
| A. | 次氯酸的电子式: | |
| B. | 乙烯的结构简式:CH2CH2 | |
| C. | S2-离子的结构示意图: | |
| D. | CS2的与CO2都是直线型分子,则CS2的比例模型为 |
 研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义.
研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义. (1)与铜同周期、基态原子最外层电子数相同的过渡元素,其基态原子的电子排布式[Ar]3d54s1.
(1)与铜同周期、基态原子最外层电子数相同的过渡元素,其基态原子的电子排布式[Ar]3d54s1.

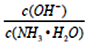 不断增大
不断增大