题目内容
16.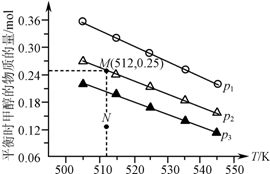 在1.0L恒容密闭容器中投入1mol CO2和2.75mol H2发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图所示.下列说法正确的是( )
在1.0L恒容密闭容器中投入1mol CO2和2.75mol H2发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图所示.下列说法正确的是( )| A. | 该反应的正反应为放热反应 | |
| B. | 压强大小关系为p1<p2<p3 | |
| C. | M点对应的平衡常数K的值约为1.04×10-2 | |
| D. | 在p2及512 K时,图中N点v(正)<v(逆) |
分析 A.根据图象,随着温度升高,平衡时甲醇的物质的量在减小,所以升温平衡向逆反应方向移动;
B.根据图象,作一条等温线,根据该反应为气体体积减小的反应,压强越大,平衡时甲醇的物质的量也越大判断;
C.由图可知,M点对应的甲醇产量为0.25mol,据此列三段式结合平衡常数K的计算公式进行计算;
D.由图可知,在p2及512 K时,N点甲醇的物质的量还小于平衡时的量,所以应该正向移动;
解答 解:A.由图可知,随着温度升高,平衡时甲醇的物质的量在减小,所以升温平衡向逆反应方向移动,则正反应为放热反应,故A正确;
B.由图可知,作一条等温线,因为该反应为气体体积减小的反应,压强越大,平衡时甲醇的物质的量也越大,所以p1>p2>p3,故B错误;
C.由图可知,M点对应的甲醇产量为0.25mol,则
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
开始 1 2.75 0 0
反应 0.25 0.75 0.25 0.25
平衡 0.75 2 0.25 0.25
又体积为1.0L,所以K=0.25×0.250.75×23=1.04×10-2;故C正确;
D.由图可知,在p2及512 K时,N点甲醇的物质的量还小于平衡时的量,所以应该正向移动,则v(正)>v(逆),故D错误;
故选AC.
点评 本题考查温度、压强等之间的关系,明确外界条件对平衡的影响,学会采用定一议二法分析图象是解本题的关键,难度不大.

练习册系列答案
相关题目
7.下列所述的操作中没有涉及到化学变化的是( )
| A. | 豆科作物的根瘤菌对空气中氮的固定 | |
| B. | 将NO2气体冷却后颜色会变浅 | |
| C. | 通过煤的液化来提取苯、二甲苯等化工原料 | |
| D. | 工业制液态氧 |
5.下列关于化学用语的表示正确的是( )
| A. | 水合氢离子的电子式: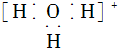 | B. | 氯离子的结构示意图: | ||
| C. | 中子数为28的钙原子:2028Ca | D. | 聚丙烯的结构简式: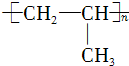 |
12.短周期元素X、Y、Z、W的原子序数依次增大.它们分别位于不同的主族,X的最高正价与最低负价代数和为0,Y为金属元素,Y与Z最外层电子数之和与W的相等,X与W所在族序数之和等于10.下列说法正确的是( )
| A. | 原子半径大小顺序:r(W)>r(Z)>r(Y)>r(X) | |
| B. | W分别与X、Y形成的化合物中化学键类型相同 | |
| C. | X的最高价氧化物的水化物的酸性比Z的弱 | |
| D. | Z的简单氢化物的热稳定性比W的强 |
20.固体乙醇晶体中不存在的作用力是( )
| A. | 氢键 | B. | 极性键 | C. | 非极性键 | D. | 离子键 |
3.设NA为阿伏加德罗常数的值,则下列说法正确的是( )
| A. | 电解精炼铜时,若阳极质量减少6.4 g,则电路中转移电子数为0.2NA | |
| B. | 向NH4Al(SO4)2稀溶液中逐滴加入过量Ba(OH)2溶液,离子方程式为:NH4++Al3++2SO42-+2Ba2++5OH-=2BaSO4↓+AlO2-+2H2O+NH3•H2O | |
| C. | 常温下,由水电离出的H+浓度为10-13mol•L-1的溶液中,Fe2+、Cl-、Na+、NO3-可能大量共存 | |
| D. | 葡萄糖(C6H12O6)溶液中:SO42-、MnO4-、K+、H+可以大量共存 |

 (1)与铜同周期、基态原子最外层电子数相同的过渡元素,其基态原子的电子排布式[Ar]3d54s1.
(1)与铜同周期、基态原子最外层电子数相同的过渡元素,其基态原子的电子排布式[Ar]3d54s1.