题目内容
11.下列实验方案中,不能达到实验目的是( )| 选项 | 实验目的 | 实验方案 |
| A | 检验淀粉是否水解生成葡萄糖 | 向淀粉溶液中加入稀H2SO4,加热几分钟,冷却后水解液用NaOH溶液中和,然后再加入新制Cu(OH)2浊液,加热,观察是否有红色沉淀生成 |
| B | 检验Fe(NO3)2晶体是否已氧化变质 | 将Fe(NO3)2样品溶于稀硫酸后,滴加KSCN溶液,观察溶液是否变红 |
| C | 验证Br2的氧化性强于I2 | 将少量溴水加入KI溶液中,再加入CCl4,振荡,静置,可观察到下层液体呈紫色 |
| D | 验证Fe(OH)3的溶解度小于Mg(OH)2 | 将FeCl3溶液加入Mg(OH)2悬浊液中,振荡,可观察到沉淀由白色变为红褐色 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.淀粉在酸性条件下可水解生成葡萄糖,葡萄糖与氢氧化铜的反应在碱性条件下进行;
B.硝酸根离子在酸性条件下具有强氧化性;
C.根据是否有碘生成判断;
D.沉淀由白色变为红褐色,说明生成氢氧化铁.
解答 解:A.淀粉在酸性条件下可水解生成葡萄糖,葡萄糖与氢氧化铜的反应在碱性条件下进行,可完成实验,故A正确;
B.硝酸根离子在酸性条件下具有强氧化性,不能确定是否变质,应直接加入KSCN溶液检验,故B错误;
C.观察到下层液体呈紫色,说明有碘生成,则Br2的氧化性强于I2,故C正确;
D.沉淀由白色变为红褐色,说明生成氢氧化铁,则Fe(OH)3的溶解度小于Mg(OH)2,故D正确.
故选B.
点评 本题考查较为综合,涉及性质检验的实验方案的评价,为高考常见题型和高频考点,侧重于学生的分析、实验能力的考查,注意把握实验的严密性和可行性的评价,难度不大.

练习册系列答案
相关题目
4.设NA表示阿伏加德罗常数,下列叙述正确的是( )
| A. | 一定条件下6.4g SO2与足量氧气反应生成SO3,转移电子数为0.2 NA | |
| B. | 1 mol AlCl3在熔融状态时离子总数为0.4NA | |
| C. | 标况下,11.2 L氯气完全溶于1 L水中,所得溶液中Cl-和ClO-两种粒子数之和为NA | |
| D. | 6.4 g由S2、S4、S8组成的混合物含硫原子数为0.2 NA |
5.下列关于化学用语的表示正确的是( )
| A. | 水合氢离子的电子式: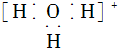 | B. | 氯离子的结构示意图: | ||
| C. | 中子数为28的钙原子:2028Ca | D. | 聚丙烯的结构简式: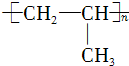 |
20.固体乙醇晶体中不存在的作用力是( )
| A. | 氢键 | B. | 极性键 | C. | 非极性键 | D. | 离子键 |
16.下列有关实验装置进行的相应实验,能达到实验目的是( )

| A. | 用图1所示装置制取干燥的氨气 | |
| B. | 图2装置可用于制取少量纯净的CO2气体 | |
| C. | 用图3所示装置将溶液定容到100 mL | |
| D. | 图4装置可用于比较碳酸钠和碳酸氢钠的热稳定性,大试管A中装碳酸钠固体,小试管B中装碳酸氢钠固体 |
3.设NA为阿伏加德罗常数的值,则下列说法正确的是( )
| A. | 电解精炼铜时,若阳极质量减少6.4 g,则电路中转移电子数为0.2NA | |
| B. | 向NH4Al(SO4)2稀溶液中逐滴加入过量Ba(OH)2溶液,离子方程式为:NH4++Al3++2SO42-+2Ba2++5OH-=2BaSO4↓+AlO2-+2H2O+NH3•H2O | |
| C. | 常温下,由水电离出的H+浓度为10-13mol•L-1的溶液中,Fe2+、Cl-、Na+、NO3-可能大量共存 | |
| D. | 葡萄糖(C6H12O6)溶液中:SO42-、MnO4-、K+、H+可以大量共存 |
1.下列有关化学用语使用正确的是( )
| A. | 次氯酸的电子式: | |
| B. | 乙烯的结构简式:CH2CH2 | |
| C. | S2-离子的结构示意图: | |
| D. | CS2的与CO2都是直线型分子,则CS2的比例模型为 |
 研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义.
研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义.