题目内容
6.若某原子在处于能量最低状态时,外围电子排布为3d14s2,则下列说法正确的是( )| A. | 该元素原子处于能量最低状态时,原子中共有3个未成对电子 | |
| B. | 该元素原子核外共有4个能层 | |
| C. | 该元素原子的M能层共有8个电子 | |
| D. | 该元素原子最外层共有3个电子 |
分析 某原子在处于能量最低状态时,外围电子排布为3d14s2,应为Sc元素,位于周期表第ⅢB族,第M层的电子排布为3s23p63d1,以此解答该题.
解答 解:根据核外电子排布规律,该元素基态原子的电子排布式为1s22s22p63s23p63d14s2.由此可见:该元素原子中共有21个电子,分4个电子层,其中M能层上有9个电子,最外层上有2个电子.
A.该元素原子处于能量最低状态时,原子中共有1未成对电子,故A错误;
B.该元素原子核外有4个电子层,故B正确;
C.该元素原子M能层共有9个电子,故C错误;
D.该元素原子最外层上有2个电子,故D错误.
故选B.
点评 本题考查核外电子排布规律,难度中等,注意根据构造原理写出元素基态原子的电子排布式.

练习册系列答案
 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
相关题目
14.下列各组稀溶液中,利用组内物质的相互反应,就能将各种物质鉴别的是( )
| A. | NaOH、CuSO4、HCl、KNO3 | B. | HCl、KOH、NaCl、Na2SO4 | ||
| C. | Ca(OH)2、Na2CO3、NaCl、HCl | D. | NaNO3、MgCl2、KCl、Ba(OH)2 |
11.反应2SO2+O2?2SO3达到平衡后,再向反应容器中充入含氧的同位素的氧气,经过一段时间后,原子存在于( )
| A. | O2 | B. | SO2 | C. | O2和SO2 | D. | O2、SO2和SO3 |
8.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 0.1mol Na2O2与水反应转移电子数目为0.1NA | |
| B. | 标况下,2.24L Cl2含孤电子对的数目为0.2NA | |
| C. | pH=2的H2SO4溶液中含H+的数目为0.1NA | |
| D. | 在10g质量分数为17%的氨水中,含有H的数目为0.3NA |
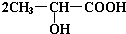 +Na2CO3→
+Na2CO3→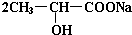 +H2O+CO2↑.
+H2O+CO2↑. .
.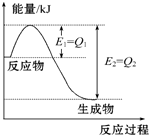 如图是一定的温度和压强下N2和H2反应生成1mol NH3过程中能量变化示意图,请写出工业合成氨的热化学方程式(△H的数值用含字母Q1、Q2的代数式表示):N2(g)+3H2(g)═2NH3(g)△H=2(Q1-Q2)kJ•mol-1.
如图是一定的温度和压强下N2和H2反应生成1mol NH3过程中能量变化示意图,请写出工业合成氨的热化学方程式(△H的数值用含字母Q1、Q2的代数式表示):N2(g)+3H2(g)═2NH3(g)△H=2(Q1-Q2)kJ•mol-1. 甲、乙两位同学为验证Mg和Al的金属活动性强弱,分别设计了如图所示的实验装置:
甲、乙两位同学为验证Mg和Al的金属活动性强弱,分别设计了如图所示的实验装置: