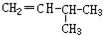题目内容
9.Cu2S和稀HNO3反应生成Cu(NO3)2、H2SO4、NO和H2O,试解答下列各题(1)用双线桥法标出电子转移的方向和数目
3Cu2S+22HNO3=6Cu(NO3)2+3H2SO4+10NO↑+8H2O
(2)当产生0.1mol NO时,转移电子总数为0.3×6.02×1023,被还原的物质为0.1mol,共耗HNO30.22mol.
(3)被1mol Cu2S中+1价亚铜离子还原的HNO3的物质的量是mol.
分析 氧化还原反应3Cu2S+22HNO3=6Cu(NO3)2+3H2SO4+10NO↑+8H2O中失电子的元素是铜和硫元素,化合价升高;得电子的元素是氮元素,化合价降低,转移的电子数目为6+3×8=30mol,当生成10molNO转移30mol电子,消耗22mol硝酸,被还原的硝酸为10mol,据此分析.
解答 解:(1)氧化还原反应3Cu2S+22HNO3=6Cu(NO3)2+3H2SO4+10NO↑+8H2O中失电子的元素是铜和硫元素,化合价升高;得电子的元素是氮元素,化合价降低,转移的电子数目为6+3×8=30mol,电子转移情况为: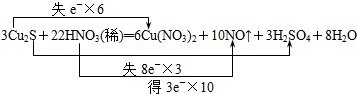 ,故答案为:
,故答案为: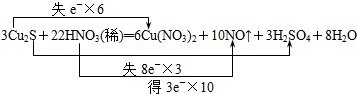 ;
;
(2)根据(1)的双线桥法标出电子转移的方向和数目,生成10molNO转移30mol电子,消耗22mol硝酸,被还原的硝酸为10mol,所以当产生0.1mol NO时,转移电子总数为0.3×6.02×1023,被还原的物质为0.1mol,共耗HNO3 0.22mol,故答案为:0.3×6.02×1023;0.1;0.22;
(3)根据得失电子守恒,被1mol Cu2S中+1价亚铜离子还原的HNO3的物质的量是mol,故答案为:.
点评 本题考查氧化还原反应,题目难度不大,本题注意从化合价变化的角度分析,易错点为(1),注意双线桥法的运用.

练习册系列答案
相关题目
6.若某原子在处于能量最低状态时,外围电子排布为3d14s2,则下列说法正确的是( )
| A. | 该元素原子处于能量最低状态时,原子中共有3个未成对电子 | |
| B. | 该元素原子核外共有4个能层 | |
| C. | 该元素原子的M能层共有8个电子 | |
| D. | 该元素原子最外层共有3个电子 |
14.下列关于芳香族化合物 说法正确的是( )
说法正确的是( )
 说法正确的是( )
说法正确的是( )| A. | 1 molA能与4 mol Ag(NH3)2OH溶液发生银镜反应 | |
| B. | 核磁共振氢谱图显示有三个吸收峰 | |
| C. | 不能与FeCl3溶液发生显色反应 | |
| D. | 1 mol A能与2 mol NaHCO3完全反应放出CO2 |
1.下列物质中属于同素异形体的是( )
| A. | H2O和H2O2 | B. | 12C和14C | C. | O2和O3 | D. | SO2和SO3 |
18.下列化学反应的离子方程式正确的是( )
| A. | 氯气与氢氧化钠溶液:Cl2+2OH-=Cl-+ClO-+H2O | |
| B. | 将少量金属钠放人冷水中:Na+2H2O=Na++2OH-+H2↑ | |
| C. | 向亚硫酸钠溶液中加入足量硝酸:SO32-+2H+=SO2↑+H2O | |
| D. | 向澄清石灰水中通入过量二氧化碳:CO2+Ca2++2OH-=CaCO3↓+H2O |


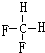 和
和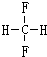
 和CH2=CH-CH2
和CH2=CH-CH2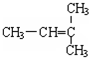 和
和