题目内容
8.下列叙述中,正确的是( )| A. | 在多电子的原子里,能量高的电子通常在离核近的区域内活动 | |
| B. | 核外电子只有排满了M层后才排N层 | |
| C. | 两种微粒,若核外电子排布完全相同,则其化学性质一定相同 | |
| D. | 化学反应的过程,本质上是旧化学键断裂和新化学键形成的过程 |
分析 A、原子核外区域能量不同,离核越近能量越低,离核越远能量越高;
B.电子首先进入能量最低、离核最近的轨道;
C.两种微粒,若核外电子排布完全相同,其性质不一定相同,根据常见的10电子微粒分析;
D.发生化学反应时,反应物中旧化学键要断裂,生成物中要形成新化学键.
解答 解:A、原子核外区域能量不同,离核越近能量越低,离核越远能量越高,所以在多电子的原子里,能量高的电子通常在离核远的区域内活动,故A错误;
B.核外电子总是先排在能量低的,因为4s轨道的能量小于3d轨道,所以先排4s,再排3d,即排满了M层的p轨道后就排N层的s轨道,后再排M层的d轨道,不是排满了M层后才排N层,故B错误;
C.两种微粒,若核外电子排布完全相同,其性质不一定相同,如Na+和Ne核外都有10个电子,电子排布相同,但是二者性质不同,故C错误;
D.发生化学反应时,反应物中旧化学键要断裂,生成物中要形成新化学键,所以化学反应的过程,本质上是旧化学键断裂和新化学键形成的过程,故D正确;
故选:D.
点评 本题考查核外电子排布规律以及元素化学性质和原子构成的关系,要知道电子首先进入能量最低、离核最近的轨道,难度不大.

练习册系列答案
相关题目
19.(1)亚硝酰氯(ClNO)是有机合成中的重要试剂,可通过反应获得:NO(g)+Cl2(g)═2ClNO(g).
①氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酰氯,涉及如下反应:
2NO2(g)+NaCl(s)?NaNO3(s)+ClNO(g)△H1 K1
4NO2(g)+2NaCl(s)?2NaNO3(s)+2NO(g)+Cl2(g)△H2 K2
2NO(g)+Cl2(g)?2ClNO(g)△H3 K3
则△H3=2△H1-△H2(用△H1和△H2表示),K3=$\frac{K_1^2}{K_2}$(用K1和K2表示).
②NaOH溶液可以吸收氮的氧化物:NO2+NO+2NaOH=2NaNO2+H2O.室温下,用一定量的NaOH
溶液吸收NO、NO2混合气体,得到0.1mol/L的NaNO2溶液.已知HNO2的电离常数Ka=7.1×10-4,
那么室温下NO2-的水解常数Kh=1.4×10-11,0.1mol/L NaNO2溶液中从c(Na+ )、c(OH- )、c(NO2- )、c(HNO2)的大小顺序为c(Na+ )>c(NO2-)>c(OH-)>c(HNO2).
(2)在3.0L密闭容器中,通入0.10mol CH4和0.20mol NO2,在一定温度下进行反应,CH4(g)+2NO2(g)?CO2(g)+N2(g)+2H2O(g)△H<0,反应时间(t)与容器内气体总压强(p)的数据见下表:
①由表中数据计算0~4min内v(NO2)=0.01mol/(L•min),该温度下的平衡常数K=0.675(不必带单位).
②在一恒容装置中,通入一定量CH4和NO2,测得在相同时间内,在不同温度下,NO2的转化率如图(横坐标为反应温度,纵坐标为NO2转化率/%):
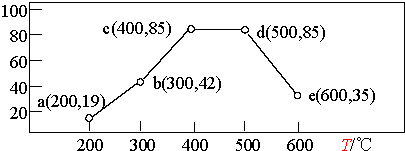
则下列叙述正确的是AD.
A.若温度维持在200℃更长时间,NO2的转化率将大于19%
B.反应速率:b点的v (逆)>e点的 v (逆)
C.平衡常数:c点=d点
D.提高b点时NO2的转化率和反应速率,可适当升温或增大c(CH4)
①氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酰氯,涉及如下反应:
2NO2(g)+NaCl(s)?NaNO3(s)+ClNO(g)△H1 K1
4NO2(g)+2NaCl(s)?2NaNO3(s)+2NO(g)+Cl2(g)△H2 K2
2NO(g)+Cl2(g)?2ClNO(g)△H3 K3
则△H3=2△H1-△H2(用△H1和△H2表示),K3=$\frac{K_1^2}{K_2}$(用K1和K2表示).
②NaOH溶液可以吸收氮的氧化物:NO2+NO+2NaOH=2NaNO2+H2O.室温下,用一定量的NaOH
溶液吸收NO、NO2混合气体,得到0.1mol/L的NaNO2溶液.已知HNO2的电离常数Ka=7.1×10-4,
那么室温下NO2-的水解常数Kh=1.4×10-11,0.1mol/L NaNO2溶液中从c(Na+ )、c(OH- )、c(NO2- )、c(HNO2)的大小顺序为c(Na+ )>c(NO2-)>c(OH-)>c(HNO2).
(2)在3.0L密闭容器中,通入0.10mol CH4和0.20mol NO2,在一定温度下进行反应,CH4(g)+2NO2(g)?CO2(g)+N2(g)+2H2O(g)△H<0,反应时间(t)与容器内气体总压强(p)的数据见下表:
| 时间t/min | 0 | 2 | 4 | 6 | 8 | 10 |
| 总压强p/100kPa | 4.80 | 5.44 | 5.76 | 5.92 | 6.00 | 6.00 |
②在一恒容装置中,通入一定量CH4和NO2,测得在相同时间内,在不同温度下,NO2的转化率如图(横坐标为反应温度,纵坐标为NO2转化率/%):

则下列叙述正确的是AD.
A.若温度维持在200℃更长时间,NO2的转化率将大于19%
B.反应速率:b点的v (逆)>e点的 v (逆)
C.平衡常数:c点=d点
D.提高b点时NO2的转化率和反应速率,可适当升温或增大c(CH4)
16.下列有关叙述正确的是( )
| A. |  如图所示,测定中和反应的反应热时,大小两烧杯间填满碎泡沫塑料的作用是固定小烧杯 如图所示,测定中和反应的反应热时,大小两烧杯间填满碎泡沫塑料的作用是固定小烧杯 | |
| B. | 若用50 mL 0.55 mol•L-1的氢氧化钠溶液,分别与50 mL 0.50 mol•L-1的盐酸和50 mLA0.50 mol•L-1的硝酸充分反应,两反应测定的反应热不相等 | |
| C. | 实验时需要记录初始温度T1 和最高温度T2 | |
| D. | 做一次实验根据公式即可得出中和反应的反应热 |
3.某化学兴趣小组要完成中和热的测定.
(1)实验桌上备有烧杯(大、小两个烧杯)、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃搅拌棒、0.5mol•L-1 盐酸、0.55mol•L-1NaOH溶液,尚缺少的实验玻璃用品是量筒、温度计.
(2)实验中能否用环形铜丝搅拌棒代替环形玻璃搅拌棒?否(填“能”或“否”),其原因是铜丝导热性良好,会对中和热的计算造成影响.
(3)他们记录的实验数据如下:
已知:Q=cm(t2-t1),反应后溶液的比热容c为4.18J•℃-1•g-1,各物质的密度均为1g•cm-3.根据实验结果写出NaOH溶液与HCl溶液反应的热化学方程式(△H值精确到小数点后2位):HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l)△H=-56.85kJ•mol-1
(4)若用KOH代替NaOH,对测定结果无(填“有”或“无”)影响.
(1)实验桌上备有烧杯(大、小两个烧杯)、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃搅拌棒、0.5mol•L-1 盐酸、0.55mol•L-1NaOH溶液,尚缺少的实验玻璃用品是量筒、温度计.
(2)实验中能否用环形铜丝搅拌棒代替环形玻璃搅拌棒?否(填“能”或“否”),其原因是铜丝导热性良好,会对中和热的计算造成影响.
(3)他们记录的实验数据如下:
| 实 验 用 品 | 溶 液 温 度 | 中和热 △H | |||
| t1 | t2 | ||||
| ① | 50mL 0.55mol.L-1NaOH | 50mL 0.5mol.L-1HCl | 20℃ | 23.3℃ | |
| ② | 50mL 0.55mol.L-1NaOH | 50mL 0.5mol.L-1HCl | 20℃ | 23.5℃ | |
(4)若用KOH代替NaOH,对测定结果无(填“有”或“无”)影响.
13.某元素原子的电子排布式是1s22s22p63s23p4,则它在周期表中的位置是( )
| A. | 第2周期第ⅣA族 | B. | 第3周期第ⅣA族 | C. | 第4周期第ⅡA族 | D. | 第3周期第ⅥA族 |
17.人类生活、生产和社会可持续发展与化学密切相关,下列说法正确的是( )
| A. | 大量燃烧化石燃料排放的废气中含大量CO2、NOx,造成大气污染,从而使雨水的pH=5.6,形成酸雨 | |
| B. | 经过必要的化学变化能从海水中提取粗盐、Mg、Br2等物质 | |
| C. | 针对病毒性流感的扩散情况,要加强环境、个人等的消毒预防,其中消毒剂常选用含氯消毒剂、酒精、双氧水等适宜的物质 | |
| D. | 石油的分馏、石油裂解、煤的气化都包含化学变化 |
18.下列说法正确的是( )
| A. | 因为碳酸、氨水能够导电,所以液氨、二氧化碳是电解质 | |
| B. | 由同种元素组成的物质一定是纯净物 | |
| C. | 由C(石墨)═C(金刚石);△H=+1.90kJ•mol-1可知,石墨比金刚石稳定 | |
| D. | 在101kPa时,2g H2完全燃烧生成液态水,放出285.8 kJ热量,则表示氢气燃烧的热化学方程式为:2H2(g)+O2 (g)═2H2O(l);△H=-285.8kJ•mol-1 |
