题目内容
17.人类生活、生产和社会可持续发展与化学密切相关,下列说法正确的是( )| A. | 大量燃烧化石燃料排放的废气中含大量CO2、NOx,造成大气污染,从而使雨水的pH=5.6,形成酸雨 | |
| B. | 经过必要的化学变化能从海水中提取粗盐、Mg、Br2等物质 | |
| C. | 针对病毒性流感的扩散情况,要加强环境、个人等的消毒预防,其中消毒剂常选用含氯消毒剂、酒精、双氧水等适宜的物质 | |
| D. | 石油的分馏、石油裂解、煤的气化都包含化学变化 |
分析 A.酸雨与二氧化硫有关,酸雨的pH<5.6;
B.提取NaCl,无需化学变化;
C.氯消毒剂、双氧水、酒精等适宜的物质可作消毒剂;
D.有新物质生成的是化学变化.
解答 解:A.酸雨与二氧化硫有关,酸雨的pH<5.6,正常雨水中溶解二氧化碳,正常雨水的pH=5.6,故A错误;
B.提取NaCl,可用蒸发、结晶的方法,无需化学变化,故B错误;
C.氯消毒剂、双氧水、酒精等适宜的物质可作消毒剂,可用于环境、个人等的消毒预防,故C正确;
D.石油分馏利用各组分的沸点不同进行分离,不涉及化学变化,故D错误.
故选C.
点评 本题考查较为综合,涉及环境污染以及化学变化等知识,侧重于基础知识的考查,有利于培养学生的良好科学素养和提高学习的积极性,难度不大.

练习册系列答案
相关题目
8.下列叙述中,正确的是( )
| A. | 在多电子的原子里,能量高的电子通常在离核近的区域内活动 | |
| B. | 核外电子只有排满了M层后才排N层 | |
| C. | 两种微粒,若核外电子排布完全相同,则其化学性质一定相同 | |
| D. | 化学反应的过程,本质上是旧化学键断裂和新化学键形成的过程 |
12.已知汽车尾气无害化处理反应为2NO(g)+2CO(g)?N2(g)+2CO2(g).下列说法不正确的是( )
| A. | 汽车尾气中有毒的NO和CO气体经充分反应后,理论上可完全转化为N2和CO2 | |
| B. | 使用高效催化剂可有效增大正反应速率 | |
| C. | 反应达到平衡后,NO的反应速率保持恒定 | |
| D. | 单位时间内CO和CO2减少的物质的量相等时,反应达到平衡 |
2.中学化学中有很多“规律”都有其适用范围,下列根据有关“规律”推出的结论正确的是( )
| 选项 | 规律 | 结论 |
| A | 强酸可以制弱酸 | 氢硫酸(H2S)无法制取硫酸 |
| B | 反应物浓度越大,反应速度越快 | 常温下,相同的铝片分别加入到浓、稀硫酸中,浓硫酸中铝片先溶解完 |
| C | 结构和组成相似的物质,沸点随着相对分子质量增大而升高 | NH3的沸点低于PH3 |
| D | 溶解 度小的沉淀易向溶解度更小的沉淀转化 | AgCl沉淀中滴定KI溶液,会得到AgI沉淀 |
| A. | A | B. | B | C. | C | D. | D |

 地下水中硝酸盐造成的氮污染已成为一个世界性的环境问题.文献报道某课题组模拟地下水脱氮过程,利用Fe粉和KNO3溶液反应,探究脱氮原理及相关因素对脱氮速率的影响.
地下水中硝酸盐造成的氮污染已成为一个世界性的环境问题.文献报道某课题组模拟地下水脱氮过程,利用Fe粉和KNO3溶液反应,探究脱氮原理及相关因素对脱氮速率的影响.
 ;
; _,反应类型是消去反应;
_,反应类型是消去反应; (其中任一种);(任写一种)
(其中任一种);(任写一种)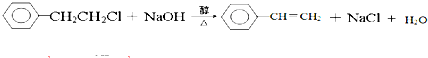 .
.