题目内容
18.下列说法正确的是( )| A. | 因为碳酸、氨水能够导电,所以液氨、二氧化碳是电解质 | |
| B. | 由同种元素组成的物质一定是纯净物 | |
| C. | 由C(石墨)═C(金刚石);△H=+1.90kJ•mol-1可知,石墨比金刚石稳定 | |
| D. | 在101kPa时,2g H2完全燃烧生成液态水,放出285.8 kJ热量,则表示氢气燃烧的热化学方程式为:2H2(g)+O2 (g)═2H2O(l);△H=-285.8kJ•mol-1 |
分析 A.液氨、二氧化碳的水溶液导电,但不是本身导电;
B.由同种元素组成的物质也可能是混合物;
C.石墨能量比金刚石小,较稳定;
D.2g氢气为1mol,2mol氢气反应放热为571.6kJ.
解答 解:A.液氨、二氧化碳的水溶液导电,但不是本身导电,它们属于非电解质,故A错误;
B.由同种元素组成的物质也可能是混合物,如氧气和臭氧组成的物质属于混合物,故B错误;
C.反应为吸热反应,则石墨能量比金刚石小,能量越低越稳定,故C正确;
D.氢气的燃烧反应为放热反应,且化学计量数与放热成正比,所以氢气燃烧的热化学方程式为:2H2 (g)+O2(g)═2H2O(1)△H=-571.6 kJ•mol,故D错误,故选C.
点评 本题考查反应热与焓变,综合考查学生对化学反应与能量变化的理解,为高考常见题型,注意相关基础知识的积累,注意把握问题的角度,理解物质的聚集状态与能量的关系、稳定的大小比较以及弱电解质的电离等问题.

练习册系列答案
 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案
相关题目
8.下列叙述中,正确的是( )
| A. | 在多电子的原子里,能量高的电子通常在离核近的区域内活动 | |
| B. | 核外电子只有排满了M层后才排N层 | |
| C. | 两种微粒,若核外电子排布完全相同,则其化学性质一定相同 | |
| D. | 化学反应的过程,本质上是旧化学键断裂和新化学键形成的过程 |
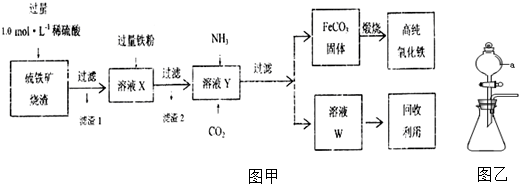
8.印刷电路的废腐蚀液含有大量CuCl2、FeCl2和FeCl3,任意排放将导致环境污染及资源的浪费,必须加以回收利用.用FeCl3溶液浸泡印刷电路板后的废液制备CuCl2•2H2O的过程如图:

(1)证明步骤1所加FeCl3溶液过量的方法是取步骤1反应后的溶液于试管中,滴加KSCN溶液少许,若溶液呈红色说明氯化铁溶液过量.
(2)步骤2所加的氧化剂最适宜的是B(填字母).A.HNO3 B.H2O2 C.KMnO4
(3)步骤3的目的是使溶液的pH升高到4.2,此时Fe3+完全沉淀,可选用的“试剂1”是CuO(写出一种即可).
(4)已知表格数据:
对含等物质的量的CuCl2、FeCl2、FeCl3的混合溶液的说法,合理的是ABC(填字母).
A.向该混合溶液中逐滴加入NaOH溶液,最先看到红褐色沉淀
B.该溶液中c(Cl-):[c(Cu2+)+c(Fe2+)+c(Fe3+)]>7:3
C.向该溶液中加入适量氯水,并调节pH到3~4后过滤,可获得纯净的CuCl2溶液
D.在pH=5的溶液中Fe2+不能大量存在
(5)蒸发浓缩CuCl2溶液时,要滴加浓盐酸,目的是CuCl2溶液水解生成氢氧化铜和盐酸,CuCl2+2H2O?Cu(OH)2+2HCl,滴加浓盐酸抑制氯化铜的水解(用化学方程式结合简要的文字说明),再经冷却、结晶、过滤,得到CuCl2•2H2O.

(1)证明步骤1所加FeCl3溶液过量的方法是取步骤1反应后的溶液于试管中,滴加KSCN溶液少许,若溶液呈红色说明氯化铁溶液过量.
(2)步骤2所加的氧化剂最适宜的是B(填字母).A.HNO3 B.H2O2 C.KMnO4
(3)步骤3的目的是使溶液的pH升高到4.2,此时Fe3+完全沉淀,可选用的“试剂1”是CuO(写出一种即可).
(4)已知表格数据:
| 物质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
| Ksp/25℃ | 8.0×10-16 | 2.2×10-29 | 4.0×10-38 |
| 完全沉淀时的pH范围 | ≥9.6 | ≥6.4 | 3~4 |
A.向该混合溶液中逐滴加入NaOH溶液,最先看到红褐色沉淀
B.该溶液中c(Cl-):[c(Cu2+)+c(Fe2+)+c(Fe3+)]>7:3
C.向该溶液中加入适量氯水,并调节pH到3~4后过滤,可获得纯净的CuCl2溶液
D.在pH=5的溶液中Fe2+不能大量存在
(5)蒸发浓缩CuCl2溶液时,要滴加浓盐酸,目的是CuCl2溶液水解生成氢氧化铜和盐酸,CuCl2+2H2O?Cu(OH)2+2HCl,滴加浓盐酸抑制氯化铜的水解(用化学方程式结合简要的文字说明),再经冷却、结晶、过滤,得到CuCl2•2H2O.

 ;
; _,反应类型是消去反应;
_,反应类型是消去反应; (其中任一种);(任写一种)
(其中任一种);(任写一种)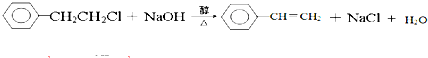 .
.