题目内容
19.(1)亚硝酰氯(ClNO)是有机合成中的重要试剂,可通过反应获得:NO(g)+Cl2(g)═2ClNO(g).①氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酰氯,涉及如下反应:
2NO2(g)+NaCl(s)?NaNO3(s)+ClNO(g)△H1 K1
4NO2(g)+2NaCl(s)?2NaNO3(s)+2NO(g)+Cl2(g)△H2 K2
2NO(g)+Cl2(g)?2ClNO(g)△H3 K3
则△H3=2△H1-△H2(用△H1和△H2表示),K3=$\frac{K_1^2}{K_2}$(用K1和K2表示).
②NaOH溶液可以吸收氮的氧化物:NO2+NO+2NaOH=2NaNO2+H2O.室温下,用一定量的NaOH
溶液吸收NO、NO2混合气体,得到0.1mol/L的NaNO2溶液.已知HNO2的电离常数Ka=7.1×10-4,
那么室温下NO2-的水解常数Kh=1.4×10-11,0.1mol/L NaNO2溶液中从c(Na+ )、c(OH- )、c(NO2- )、c(HNO2)的大小顺序为c(Na+ )>c(NO2-)>c(OH-)>c(HNO2).
(2)在3.0L密闭容器中,通入0.10mol CH4和0.20mol NO2,在一定温度下进行反应,CH4(g)+2NO2(g)?CO2(g)+N2(g)+2H2O(g)△H<0,反应时间(t)与容器内气体总压强(p)的数据见下表:
| 时间t/min | 0 | 2 | 4 | 6 | 8 | 10 |
| 总压强p/100kPa | 4.80 | 5.44 | 5.76 | 5.92 | 6.00 | 6.00 |
②在一恒容装置中,通入一定量CH4和NO2,测得在相同时间内,在不同温度下,NO2的转化率如图(横坐标为反应温度,纵坐标为NO2转化率/%):
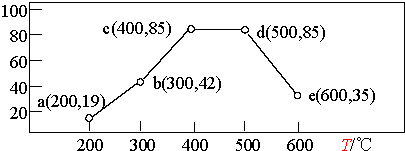
则下列叙述正确的是AD.
A.若温度维持在200℃更长时间,NO2的转化率将大于19%
B.反应速率:b点的v (逆)>e点的 v (逆)
C.平衡常数:c点=d点
D.提高b点时NO2的转化率和反应速率,可适当升温或增大c(CH4)
分析 (1)①已知:I.2NO2(g)+NaCl(s)?NaNO3(s)+ClNO(g)
Ⅱ.4NO2(g)+2NaCl(s)?2NaNO3(s)+2NO(g)+Cl2(g)
根据盖斯定律,Ⅰ×2-Ⅱ可得:2NO(g)+Cl2(g)?2ClNO(g),焓变也进行相应计算,该反应平衡常数等于I的平衡常数平方与II的平衡常数的商;
②NO2-的水解常数Kh=$\frac{c(HN{O}_{2})×c(O{H}^{-})}{c(N{{O}_{2}}^{-})}$=$\frac{c(HN{O}_{2})×c({H}^{+})×c(O{H}^{-})}{c(N{{O}_{2}}^{-})×c({H}^{+})}$=$\frac{Kw}{{K}_{a}(HN{O}_{2})}$,溶液中NO2-离子水解,溶液呈碱性,水也电离生成氢氧根离子;
(2)①压强之比等于物质的量之比,则4min时混合气体总物质的量为(0.1+0.2)mol×$\frac{5.76}{4.8}$=0.36mol,由方程式可知2molNO2反应时混合气体物质的量增大1mol,则反应的NO2为2×(0.36-0.3)mol=0.12mol,再根据c=$\frac{△c}{△t}$计算0~4min内v(NO2);
8min时处于平衡状态,压强之比等于物质的量之比,则平衡时混合气体总物质的量为(0.1+0.2)mol×$\frac{6}{4.8}$=0.375mol,再计算平衡时各组分的物质的量,根据K=$\frac{c(C{O}_{2})×c({N}_{2})×{c}^{2}({H}_{2}O)}{c(C{H}_{4})×{c}^{2}(N{O}_{2})}$计算平衡常数;
②图为测得在相同时间内,在不同温度下NO2的转化率,温度400℃、500℃转化率最大,处于平衡状态,之前没有到达平衡,之后升高温度,转化率降低,平衡逆向移动.
A.图中200℃时,反应没有到达平衡,向正反应进行;
B.b点反应向正反应进行,e点为较高温下平衡状态;
C.c、d温度不同,平衡常数不同;
D.增大反应物浓度可以加快反应速率,提高其他物质的转化率,b向正反应进行,当升温可以加快速率,反应继续向正反应进行并到达平衡.
解答 解:(1)①已知:I.2NO2(g)+NaCl(s)?NaNO3(s)+ClNO(g)
Ⅱ.4NO2(g)+2NaCl(s)?2NaNO3(s)+2NO(g)+Cl2(g)
根据盖斯定律,Ⅰ×2-Ⅱ可得:2NO(g)+Cl2(g)?2ClNO(g),该反应△=2△H1-△H2,平衡常数K3=$\frac{K_1^2}{K_2}$,
故答案为:2△H1-△H2;$\frac{K_1^2}{K_2}$;
②NO2-的水解常数Kh=$\frac{c(HN{O}_{2})×c(O{H}^{-})}{c(N{{O}_{2}}^{-})}$=$\frac{c(HN{O}_{2})×c({H}^{+})×c(O{H}^{-})}{c(N{{O}_{2}}^{-})×c({H}^{+})}$=$\frac{Kw}{{K}_{a}(HN{O}_{2})}$=$\frac{1{0}^{-14}}{7.1×1{0}^{-4}}$=1.4×10-11,溶液中NO2-离子水解,溶液呈碱性,水也电离生成氢氧根离子,浓度顺序为:c(Na+ )>c(NO2-)>c(OH-)>c(HNO2),
故答案为:1.4×10-11;c(Na+ )>c(NO2-)>c(OH-)>c(HNO2);
(2)①压强之比等于物质的量之比,则4min时混合气体总物质的量为(0.1+0.2)mol×$\frac{5.76}{4.8}$=0.36mol,由方程式可知1molNO2反应时混合气体物质的量增大1mol,则反应的NO2为2×(0.36-0.3)mol=0.12mol,0~4min内v(NO2)=$\frac{\frac{0.12mol}{3L}}{4min}$=0.01mol/(L•min);
8min时处于平衡状态,压强之比等于物质的量之比,则平衡时混合气体总物质的量为(0.1+0.2)mol×$\frac{6}{4.8}$=0.375mol,设参加反应的均为为xmol,则:
CH4(g)+2NO2(g)?CO2(g)+N2(g)+2H2O(g)
起始量(mol):0.1 0.2 0 0 0
变化量(mol):x 2x x x 2x
平衡量(mol):0.1-x 0.2-2x x x 2x
所以0.1-x+0.2-2x+x+x+2x=0.375,解得x=0.075,
则平衡常数K=$\frac{c(C{O}_{2})×c({N}_{2})×{c}^{2}({H}_{2}O)}{c(C{H}_{4})×{c}^{2}(N{O}_{2})}$=$\frac{\frac{0.075}{3}×\frac{0.075}{3}×(\frac{0.15}{3})^{2}}{\frac{0.025}{3}×(\frac{0.05}{3})^{2}}$=0.675,
故答案为:0.01mol/(L•min);0.675;
②图为测得在相同时间内,在不同温度下NO2的转化率,温度400℃、500℃转化率最大,处于平衡状态,之前没有到达平衡,之后升高温度,转化率降低,平衡逆向移动.
A.图中200℃时,反应没有到达平衡,向正反应进行,温度维持在200℃更长时间,NO2的转化率将大于19%,故A正确;
B.b点反应向正反应进行,e处于平衡状态,且E温度高,故b点的v (逆)<e点的 v (逆),故B错误;
C.c、d温度不同,平衡常数不同,故C错误;
D.增大反应物浓度可以加快反应速率,提高其他物质的转化率,b向正反应进行,当升温可以加快速率,反应继续向正反应进行并到达平衡,故D正确,
故选:AD.
点评 本题考查化学平衡计算与影响因素、化学平衡常数、水解常数、反应热计算、浓度大小比较等,(2)中图象注意c、d点转化率相同,由于温度不同,平衡常数不相同.

 寒假学与练系列答案
寒假学与练系列答案
已知:

| 密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
| 环己醇 | 0.96 | 25 | 161 | 能溶于水 |
| 环己烯 | 0.81 | -103 | 83 | 难溶于水 |
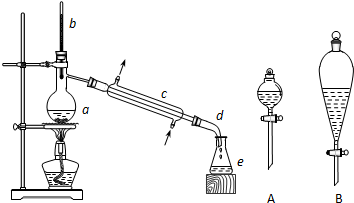
将12.5mL环己醇加入试管A中,再加入1mL浓硫酸,摇匀后放入碎瓷片(防止爆沸),缓慢加热至反应完全,在试管C内得到环己烯粗品.
①导管B除了导气外还具有的作用是冷凝.
②试管C置于冰水浴中的目的是防止环己烯的挥发.
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等.加入饱和食盐水,振荡、静置、分层,环己烯在上层(填“上”或“下”),分液后用C(填入编号)洗涤.
A.KMnO4溶液 B.稀H2SO4C.Na2CO3溶液
②再将环己烯按上图装置蒸馏,冷却水从g口进入(填“g”或“f”).蒸馏时要加入生石灰,其目的是除去水分.
③收集产品时,控制的温度应在83℃左右,实验制得的环己烯精品质量低于理论产量,可能的原因是C.
A.蒸馏时从70℃开始收集产品
B.环己醇实际用量多了
C.制备粗品时环己醇随产品一起蒸出
(3)以下区分环己烯精品和粗品的方法,合理的是BC.
A.分别加入酸性高锰酸钾溶液
B.分别加入用金属钠
C.分别测定沸点.
| 正丁醇 | 冰醋酸 | 乙酸正丁酯 | 正丁醚 | |
| 密度/(g/cm3) | 0.810 | 1.049 | 0.882 | 0.7689 |
| 沸点/℃ | 118.0 | 118.1 | 126.1 | 142 |
①将仪器a中反应后的混合液与仪器e中的馏出物合并,转入分液漏斗中;
②依次用水、少量10%的碳酸钠溶液和水洗涤,分离后再加干燥剂M,静置一段时间后,弃去M;
③将最终得到的反应粗产物转入洗净的仪器a中,加入几粒沸石,进行蒸馏,得到乙酸正丁酯9.1g.请回答下列问题:
(1)仪器a的名称是蒸馏烧瓶.
(2)在分液时应选如右图装置中的B(填序号).
(3)写出制备乙酸正丁酯的化学方程式:CH3COOH+CH3CH2CH2CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH2CH2CH3+H2O.
(4)第一次水洗的目的是除去硫酸及部分乙酸.
(5)干燥剂M可以是B(填序号)
A.五氧化二磷B.无水硫酸钠C.碱石灰D.氢氧化钠固体
(6)本实验所得到的乙酸正丁酯的产率是61.1%.
| 时间(min) 浓度(mol•L-1) | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.00 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
| N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
| CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
| A. | 在多电子的原子里,能量高的电子通常在离核近的区域内活动 | |
| B. | 核外电子只有排满了M层后才排N层 | |
| C. | 两种微粒,若核外电子排布完全相同,则其化学性质一定相同 | |
| D. | 化学反应的过程,本质上是旧化学键断裂和新化学键形成的过程 |

 酚醛树脂(phenolic resin)是人类合成的第一种高分子材料,至今仍被广泛使用.某校化学兴趣小组的同学通过下列方法在实验室制备酚醛树脂:
酚醛树脂(phenolic resin)是人类合成的第一种高分子材料,至今仍被广泛使用.某校化学兴趣小组的同学通过下列方法在实验室制备酚醛树脂: .
.
 ;
; _,反应类型是消去反应;
_,反应类型是消去反应; (其中任一种);(任写一种)
(其中任一种);(任写一种)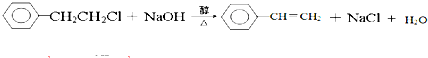 .
.