题目内容
20.CuCl和CuCl2都是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等.已知:①CuCl可以由CuCl2用适当的还原剂如SO2、SnCl2等还原制得:
2Cu2++2Cl-+SO2+2H2O═2CuCl↓+4H++SO42-
2CuCl+SnCl2═2CuCl↓+SnCl4
②CuCl2溶液与乙二胺(H2N-CH2-CH2-NH2)可形成配离子[Cu(En)2]2+(En是乙二胺的简写):

请回答下列问题:
(1)配离子[Cu(En)2]2+的中心原子基态外围电子排布式为3d9,H、N、O三种元素的电负性由大到小的顺序是O>N>H;
(2)SO2分子的空间构型为V型;
(3)乙二胺分子中氮原子轨道的杂化类型为sp3杂化,乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高的多,原因是乙二胺分子之间可以形成氢键,三甲胺分子之间不能形成氢键.
(4)如图1配离子[Cu(En)2]2+的配位数为4,该微粒含有的微粒间的作用力类型有ABD(填字母);
A.配位键 B.极性键 C.离子键 D.非极性键E.氢键 F.金属键
(5)CuCl的晶胞结构如图2所示,其中Cl-的配位数(即与Cl-最近距离的Cu+的个数)为4.
分析 (1)根据核外电子排布规律书写Cu原子的核外电子排布式,电子按能层高低进行失去,进而书写Cu2+的外围电子排布式;
同周期自左而右,电负性增大,据此判断O、N元素的电负性,H元素与O、N元素化合时,表现正化合价,H元素的电负性比O、N元素小;
(2)SO2分子的中心原子S原子的杂化轨道数为3,采取sp2杂化,含有1对孤对电子对,为V型结构;
(3)乙二胺(H2N-CH2-CH2-NH2)中N原子呈3个σ键,含有1对孤对电子,杂化轨道数为4,采取sp3杂化;
乙二胺(H2N-CH2-CH2-NH2)分子之间可以形成氢键,但三甲胺[N(CH3)3]分子之间不能形成氢键;
(4)由图1可知配离子[Cu(En)2]2+的配位数为4,离子中存在配位键、C-N键、C-H键、N-H键、C-C键,据此判断离子化学键类型;
(5)由CuCl的晶胞结构图可知,每个Cu+周围有4个Cl-,故每个Cl-周围有4个Cu+.
解答 解:(1)Cu原子的核外电子排布式为1s22s22p63s23p63d104s1,故Cu2+的外围电子排布式为3d9;
同周期自左而右,电负性增大,电负性O>N,H元素与O、N元素化合时,H元素表现正化合价,H元素的电负性比O、N元素小,故电负性O>N>H;
故答案为:3d9;O>N>H;
(2)SO2分子的中心原子S原子的杂化轨道数为$\frac{6}{2}$=3,采取sp2杂化,含有1对孤对电子对,故SO2为V型结构;
故答案为:V型;
(3)乙二胺(H2N-CH2-CH2-NH2)中N原子呈3个σ键,含有1对孤对电子,杂化轨道数为4,采取sp3杂化;
乙二胺(H2N-CH2-CH2-NH2)分子之间可以形成氢键,三甲胺[N(CH3)3]分子之间不能形成氢键,故乙二胺的沸点较高;
故答案为:sp3杂化;乙二胺分子之间可以形成氢键,三甲胺分子之间不能形成氢键;
(4)由图1可知配离子[Cu(En)2]2+的配位数为4;
离子中存在配位键、C-N键、C-H键、N-H键、C-C键,其中C-N键、C-H键、N-H键为极性键,C-C键为非极性键,故离子含有配位键、极性键、非极性键,故选ABD;
故答案为:4;ABD;
(5)由CuCl的晶胞结构图可知,每个Cu+周围有4个Cl-,故每个Cl-周围有4个Cu+;故答案为:4.
点评 本题考查核外电子排布规律、电负性、杂化轨道、分子空间结构、氢键与化学键、晶胞等,综合性较大,难度中等,是对知识的综合运用,需要学生具备扎实的基础与分析问题解决问题的能力.


已知:

| 密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
| 环己醇 | 0.96 | 25 | 161 | 能溶于水 |
| 环己烯 | 0.81 | -103 | 83 | 难溶于水 |
将12.5mL环己醇加入试管A中,再加入1mL浓硫酸,摇匀后放入碎瓷片(防止爆沸),缓慢加热至反应完全,在试管C内得到环己烯粗品.
①导管B除了导气外还具有的作用是冷凝.
②试管C置于冰水浴中的目的是防止环己烯的挥发.
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等.加入饱和食盐水,振荡、静置、分层,环己烯在上层(填“上”或“下”),分液后用C(填入编号)洗涤.
A.KMnO4溶液 B.稀H2SO4C.Na2CO3溶液
②再将环己烯按上图装置蒸馏,冷却水从g口进入(填“g”或“f”).蒸馏时要加入生石灰,其目的是除去水分.
③收集产品时,控制的温度应在83℃左右,实验制得的环己烯精品质量低于理论产量,可能的原因是C.
A.蒸馏时从70℃开始收集产品
B.环己醇实际用量多了
C.制备粗品时环己醇随产品一起蒸出
(3)以下区分环己烯精品和粗品的方法,合理的是BC.
A.分别加入酸性高锰酸钾溶液
B.分别加入用金属钠
C.分别测定沸点.
| A. | 在多电子的原子里,能量高的电子通常在离核近的区域内活动 | |
| B. | 核外电子只有排满了M层后才排N层 | |
| C. | 两种微粒,若核外电子排布完全相同,则其化学性质一定相同 | |
| D. | 化学反应的过程,本质上是旧化学键断裂和新化学键形成的过程 |
| A. | 3s23p63d2 | B. | 2d10 | C. | 3s23p64s2 | D. | 3s23p33d5 |
| A. | 汽车尾气中有毒的NO和CO气体经充分反应后,理论上可完全转化为N2和CO2 | |
| B. | 使用高效催化剂可有效增大正反应速率 | |
| C. | 反应达到平衡后,NO的反应速率保持恒定 | |
| D. | 单位时间内CO和CO2减少的物质的量相等时,反应达到平衡 |
 酚醛树脂(phenolic resin)是人类合成的第一种高分子材料,至今仍被广泛使用.某校化学兴趣小组的同学通过下列方法在实验室制备酚醛树脂:
酚醛树脂(phenolic resin)是人类合成的第一种高分子材料,至今仍被广泛使用.某校化学兴趣小组的同学通过下列方法在实验室制备酚醛树脂: .
. 地下水中硝酸盐造成的氮污染已成为一个世界性的环境问题.文献报道某课题组模拟地下水脱氮过程,利用Fe粉和KNO3溶液反应,探究脱氮原理及相关因素对脱氮速率的影响.
地下水中硝酸盐造成的氮污染已成为一个世界性的环境问题.文献报道某课题组模拟地下水脱氮过程,利用Fe粉和KNO3溶液反应,探究脱氮原理及相关因素对脱氮速率的影响.
 ;
; _,反应类型是消去反应;
_,反应类型是消去反应; (其中任一种);(任写一种)
(其中任一种);(任写一种)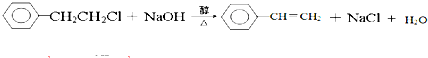 .
.