题目内容
【题目】温度为T时,在三个容积均为1L的恒容密闭容器中仅发生反应:2SO2(g)+O2(g)![]() 2SO3(g) ΔH<0,达到平衡时,下列说法不正确的是
2SO3(g) ΔH<0,达到平衡时,下列说法不正确的是
容器 编号 | 容器类型 | 起始物质的量 / mol | 平衡时SO3的物质的量 / mol | ||
SO2 | O2 | SO3 | |||
I | 恒温恒容 | 2 | 1 | 0 | 1.8 |
II | 恒温恒压 | 2 | 1 | 0 | a |
III | 绝热恒容 | 0 | 0 | 2 | b |
A. 容器I中SO2的转化率小于容器II中SO2的转化率
B. 容器II的平衡常数大于容器III中的平衡常数
C. 平衡时SO3的物质的量:a>1.8、b>1.8
D. 若起始时向容器I中充入0.10 mol SO2(g)、0.20mol O2(g)和2.0 mol SO3(g),则此时v正<v逆
【答案】B
【解析】
A.恒温恒容时,2SO2+O2![]() 2SO3平衡时,SO3的物质的量为1.8mol。该反应正向移动,达到平衡时,压强较刚开始的时候减小。恒温恒压相比于恒温恒容,相当于在恒容的平衡状态下,减小体积,维持压强不变。减小体积,增大压强,平衡向着气体体积减小的方向移动,为正反应方向,则容器II中SO2的转化率增大,A项正确,不符合题意;
2SO3平衡时,SO3的物质的量为1.8mol。该反应正向移动,达到平衡时,压强较刚开始的时候减小。恒温恒压相比于恒温恒容,相当于在恒容的平衡状态下,减小体积,维持压强不变。减小体积,增大压强,平衡向着气体体积减小的方向移动,为正反应方向,则容器II中SO2的转化率增大,A项正确,不符合题意;
B.SO2和O2反应生成SO3是放热反应,SO3分解生成SO2和O2是吸热反应。容器Ⅲ绝热情况下发生反应,则容器内的温度较容器Ⅱ中的更低。2SO2(g)+O2(g)![]() 2SO3(g) ΔH<0,温度降低,平衡常数增大,容器Ⅱ中的平衡常数小于容器Ⅲ中的平衡常数,B项错误,符合题意;
2SO3(g) ΔH<0,温度降低,平衡常数增大,容器Ⅱ中的平衡常数小于容器Ⅲ中的平衡常数,B项错误,符合题意;
C.恒温恒压相比于恒温恒容,相当于在恒容的平衡状态下,减小体积,维持压强不变。减小体积,增大压强,平衡向着气体体积减小的方向移动,为正反应方向,SO3的物质的量大于1.8,a>1.8。容器Ⅲ如果是恒温恒压,则平衡结果和容器Ⅰ中的一样,c=1.8mol,但是现在容器Ⅲ为绝热装置,SO3分解属于吸热反应,相当于达到容器Ⅰ中的平衡后,再降低温度,向放热反应方向移动,SO3的物质的量增加,b>1.8mol;C项正确,不符合题意;
D.利用三段式求出容器Ⅰ中的平衡常数K,再利用浓度商Qc和平衡常数K的关系,判断平衡移动方向。求解容器Ⅰ的平衡常数K,体积为1L。
2SO2(g)+O2(g)![]() 2SO3(g)
2SO3(g)
开始时的物质的量浓度 2 1 0
转化的物质的量浓度 1.8 0.9 1.8
平衡时的物质的量浓度 0.2 0.1 1.8
则平衡常数![]() ;
;
若起始时向容器I中充入0.10 mol SO2(g)、0.20mol O2(g)和2.0 mol SO3(g),则浓度商![]() ;浓度商Qc大于K,平衡逆向移动,则v正<v逆,D项正确,不符合题意;
;浓度商Qc大于K,平衡逆向移动,则v正<v逆,D项正确,不符合题意;
本题答案选B。

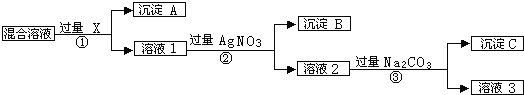
【题目】蛇纹石(含MgO、NiO、SiO2、Fe2O3、FeO等)因其外表青绿相问像蛇纹一样而得名。一种以蛇纹石为原料制取铁红和碱式碳酸镍[Ni3(OH)4CO34H2O]的流程如图:
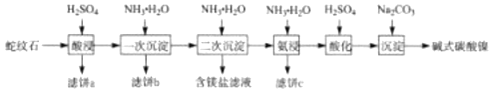
已知:Ⅰ.该实验温度下,不同pH时铁沉淀物成分及热分解产物:
pH | 铁沉淀物成分 | 热分解产物 |
2.5 | NH4Fe3(SO4)2(OH)6 | Fe2O3,SO2,SO3,NH3,O2,H2O |
3.5 | α-FeOOH | Fe2O3,H2O |
Ⅱ.部分金属离子沉淀的pH:
Mg2+ | Fe2+ | Ni2+ | |
开始沉淀的pH | 9.4 | 6.5 | 6.7 |
沉淀完全的pH | 12.4 | 9.7 | 9.5 |
Ⅲ.“氨浸“后所得溶液中主要成分为[Ni(NH3)6]2+,且存在[Ni(NH3)6]2+ Ni2++6NH3请回答:
(1)滤饼a的主要成分为___。
(2)滤饼b经洗涤、煅烧可得铁红。则“一次沉淀”时应控制pH=__(填“2.5或“3.5”),其原因为___。
(3)“氨浸”时生成[Ni(NH3)6]2+的离子方程式为___;此过程会同时加入 NH4HCO3,其目的为___。
(4)“沉淀”前须先”酸化”,用平衡移动原理解释其原因为__。
(5)实验室测得Ni3(OH)4CO34H2O(M=377)样品在空气中受热时样品失重率(失重率=固体样品损失的总质量/起始加入样品的质量×100%)与温度(T)的关系如图所示。

①200oC时所得固体的化学式为___。
②250~350oC之间反应的化学方程式为___。
(6)碱式碳酸镍可进一步转化制得镍氢电池。镍氢电池的工作原理为:Ni(OH)2+M![]() NiOOH+MH(M表示储氢金属或合金)。该电池充电过程中阴极的电极反应式为___。
NiOOH+MH(M表示储氢金属或合金)。该电池充电过程中阴极的电极反应式为___。
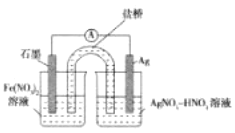
【题目】向硝酸酸化的2mL0.1molL-1AgNO3溶液(pH=2)中加入过量铁粉,振荡后静置,溶液先呈浅绿色,后逐渐呈粽黄色,试管底部仍存有黑色固体,过程中无气体生成。实验小组同学针对该实验现象进行如下探究。
Ⅰ.探究Fe2+产生的原因
(1)提出猜想:Fe2+可能是Fe与____或___反应的产物。
(2)实验探究:在两支试管中分别加入与上述实验等量的铁粉,再加入不同的液体试剂,5min后取上层清液,分别加入相同体积和浓度的铁氰化钾溶液
液体试剂 | 加人铁氰化钾溶液 | |
1号试管 | 2mL.0.1molL-1AgNO3溶液 | 无蓝色沉淀 |
2号试管 | ______ | 蓝色沉淀 |
①2号试管中所用的试剂为____。
②资料显示:该温度下,0.1molL-1的AgNO3溶液可以将Fe氧化为Fe2+。但1号试管中未观察到蓝色沉淀的原因可能为____。
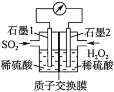
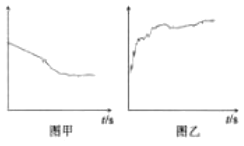
③小组同学继续进行实验,证明了2号试管得出的结论正确。实验如下:取100mL0.1molL-1硝酸酸化的AgNO3溶液(pH=2),加入铁粉井搅拌,分别插入pH传感器和NO3-传感器(传感器可检测离子浓度),得到如图图示,其中pH传感器测得的图示为___(填“图甲”或“图乙”)。
④实验测得2号试管中有NH4+生成,则2号试管中发生反应的离子方程式为___。
Ⅱ.探究Fe3+产生的原因
查阅资料可知,反应中溶液逐渐变棕黄色是因为Fe2+被Ag+氧化。小组同学设计不同实验方案对此进行验证。
(3)方案一;取出少量黑色固体,洗涤后___(填操作和现象),证明黑色固体中有Ag。
(4)方案二:按图连接装置,一段时间后取出左侧烧杯溶液,加人KSCN溶液,溶液变F红。该实验现象____(填“能“或“不能“)证明Fe2+可被Ag+氧化,理由为__。