题目内容
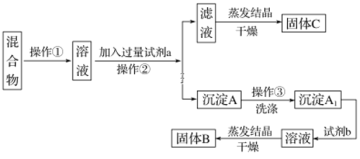
【题目】现有含NaCl、Na2SO4和NaNO3的混合溶液,选择适当的试剂除去溶液中的NaCl和Na2SO4,从而得到纯净的NaNO3溶液.相应过程用如图表示:
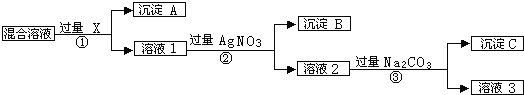
(1)写出下列物质的化学式X__________;
(2)写出步骤③涉及到的离子反应__________,__________;
(3)按此实验方案得到的溶液3中肯定含有杂质,为了解决这个问题,可以向溶液3中加入适量的__________(填化学式),之后若要获得固体NaNO3需进行的实验操作是__________(填操作名称).
【答案】Ba(NO3)2 Ba2++CO32﹣═BaCO3↓ 2Ag++CO32﹣═Ag2CO3↓ HNO3 蒸发结晶
【解析】
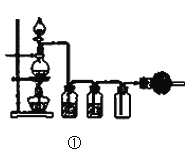
除去溶液中的氯化钠和硫酸钠,根据实验过程分析,先除去硫酸钠,应引入钡离子,不引入新杂质,可以用硝酸钡,因为还要加入硝酸银,所以可以用氯化钡,沉淀A为硫酸钡。溶液1中含有硝酸钠和氯化钡和氯化钠,加入过量的硝酸银生成氯化银沉淀,溶液2中含有硝酸钠和硝酸钡和硝酸银,加入过量的碳酸钠,得到碳酸银沉淀,溶液3为碳酸钠和硝酸钠,沉淀3为碳酸银。
(1)物质的除杂过程需加入稍过量的除杂试剂,且不能引入新杂质,所以加入过量的Ba(NO3)2;
(2)步骤③加入过量的碳酸钠,除去溶液中的Ag+和Ba2+,发生反应的离子方程式为:Ba2++CO32﹣═BaCO3↓;2Ag++CO32﹣═Ag2CO3↓;
(3)按此实验方案,因为加入的Na2CO3过量,所以得到的溶液3中肯定含有Na2CO3杂质;为了除去该杂质,可以向溶液3中加入过量的HNO3,之后若要获得纯NaNO3固体,还需进行的实验操作是蒸发结晶。

【题目】如表所示是A、B、C、D、E四种有机物的有关信息:
A | ①能使溴的四氯化碳溶液褪色;②比例模型为 |
B | ①由C、H两种元素组成;②球棍模型为 |
C | ①由C、H、O三种元素组成;②能与Na反应,但不能与NaOH溶液反应;③能与D反应生成相对分子质量为88的E |
D | ①由C、H、O三种元素组成;②球棍模型为 |
回答下列问题:
(1)写出A与溴的四氯化碳溶液反应的化学方程式:_______________。
(2)B具有的性质是________(填序号)。
①无色无味液体 ②有毒 ③不溶于水 ④密度比水大 ⑤与酸性KMnO4溶液和溴水反应褪色 ⑥任何条件下不与氢气反应
(3)B在加热时,能与混酸(浓硫酸和浓硝酸的混合溶液)反应,其化学方程式为___________。
(4)D的结构简式是____________。
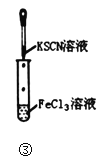
(5)如图所示,该实验装置可用于C和D反应制取E。
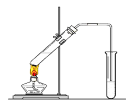
试回答下列问题:
①在右试管中通常加入__________溶液,其作用为___________;
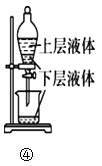
②实验生成E的反应方程式为____________,分离右试管中所得E的操作为__________(填操作名称)
【题目】温度为T时,在三个容积均为1L的恒容密闭容器中仅发生反应:2SO2(g)+O2(g)![]() 2SO3(g) ΔH<0,达到平衡时,下列说法不正确的是
2SO3(g) ΔH<0,达到平衡时,下列说法不正确的是
容器 编号 | 容器类型 | 起始物质的量 / mol | 平衡时SO3的物质的量 / mol | ||
SO2 | O2 | SO3 | |||
I | 恒温恒容 | 2 | 1 | 0 | 1.8 |
II | 恒温恒压 | 2 | 1 | 0 | a |
III | 绝热恒容 | 0 | 0 | 2 | b |
A. 容器I中SO2的转化率小于容器II中SO2的转化率
B. 容器II的平衡常数大于容器III中的平衡常数
C. 平衡时SO3的物质的量:a>1.8、b>1.8
D. 若起始时向容器I中充入0.10 mol SO2(g)、0.20mol O2(g)和2.0 mol SO3(g),则此时v正<v逆