题目内容
【题目】500℃时,向容积为2 L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g)![]() CO2(g)+H2(g) ,反应过程中测定的部分数据见表(表中t2>t1):
CO2(g)+H2(g) ,反应过程中测定的部分数据见表(表中t2>t1):
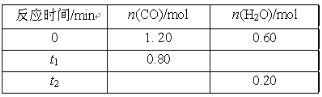
下列说法正确的是
A.增大压强对正逆反应速率没有影响,平衡不移动
B.保持其他条件不变,起始时向容器中充入0.60molCO和1.20molH2O(g),达到平衡时n(CO2)=0.40mol
C.保持其他条件不变,向平衡体系中再通入0.20molH2O(g),与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数增大
D.由表格中数据得出,t1时刻该反应还未达到平衡
【答案】BC
【解析】
A.增大压强正逆反应速率都增大,因为CO(g)+H2O(g)![]() CO2(g)+H2(g)两边计量数相等,所以平衡不移动,故A错误;
CO2(g)+H2(g)两边计量数相等,所以平衡不移动,故A错误;
B.由方程式可知CO和H2O(g)的量对该反应的影响相同,所以起始时向容器中充入0.60molCO和1.20molH2O(g)与起始时向容器中充入1.20molCO和0.60molH2O(g)属于等效平衡,达到相同的平衡状态,对比表中反应时间为0、t1、t2三个时间的数据0![]() t1,CO减少0.40mol,根据方程式计算H2O(g)也应减少0.40mol;而到t2时H2O(g)的减少量仍然为0.40mol,说明t1时已经达平衡。根据t1时的数据可求得n(CO2)=0.40mol,故B正确;
t1,CO减少0.40mol,根据方程式计算H2O(g)也应减少0.40mol;而到t2时H2O(g)的减少量仍然为0.40mol,说明t1时已经达平衡。根据t1时的数据可求得n(CO2)=0.40mol,故B正确;
C.增大反应物水蒸气的浓度,平衡正向移动,CO转化率增大,水蒸气的转化率降低,水蒸气的体积分数增大,故C正确;
D.由B项分析可知,t1时已经达平衡,故D错误;
答案为BC。

【题目】如表所示是A、B、C、D、E四种有机物的有关信息:
A | ①能使溴的四氯化碳溶液褪色;②比例模型为 |
B | ①由C、H两种元素组成;②球棍模型为 |
C | ①由C、H、O三种元素组成;②能与Na反应,但不能与NaOH溶液反应;③能与D反应生成相对分子质量为88的E |
D | ①由C、H、O三种元素组成;②球棍模型为 |
回答下列问题:
(1)写出A与溴的四氯化碳溶液反应的化学方程式:_______________。
(2)B具有的性质是________(填序号)。
①无色无味液体 ②有毒 ③不溶于水 ④密度比水大 ⑤与酸性KMnO4溶液和溴水反应褪色 ⑥任何条件下不与氢气反应
(3)B在加热时,能与混酸(浓硫酸和浓硝酸的混合溶液)反应,其化学方程式为___________。
(4)D的结构简式是____________。
(5)如图所示,该实验装置可用于C和D反应制取E。
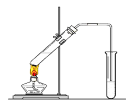
试回答下列问题:
①在右试管中通常加入__________溶液,其作用为___________;
②实验生成E的反应方程式为____________,分离右试管中所得E的操作为__________(填操作名称)
【题目】根据下列实验操作和现象所得到的结论正确的是
选项 | 实验操作和现象 | 实验结论 |
A |
| 装置气密性良好 |
B | 将氧化铁加入到足量的HI溶液中,充分溶解后,滴加四氯化碳,震荡静置,下层呈紫红色。 | I2氧化性强与Fe3+ |
C | 往氢氧化铜沉淀中分别滴加盐酸和氨水,沉淀皆溶解 | 氢氧化铜为两性氢氧化物 |
D | 将SO2通入Na2CO3溶液中生成的气体,通入澄清石灰水中有浑浊 | 说明酸性:H2SO3﹥H2CO3 |
A.AB.BC.CD.D
【题目】温度为T时,在三个容积均为1L的恒容密闭容器中仅发生反应:2SO2(g)+O2(g)![]() 2SO3(g) ΔH<0,达到平衡时,下列说法不正确的是
2SO3(g) ΔH<0,达到平衡时,下列说法不正确的是
容器 编号 | 容器类型 | 起始物质的量 / mol | 平衡时SO3的物质的量 / mol | ||
SO2 | O2 | SO3 | |||
I | 恒温恒容 | 2 | 1 | 0 | 1.8 |
II | 恒温恒压 | 2 | 1 | 0 | a |
III | 绝热恒容 | 0 | 0 | 2 | b |
A. 容器I中SO2的转化率小于容器II中SO2的转化率
B. 容器II的平衡常数大于容器III中的平衡常数
C. 平衡时SO3的物质的量:a>1.8、b>1.8
D. 若起始时向容器I中充入0.10 mol SO2(g)、0.20mol O2(g)和2.0 mol SO3(g),则此时v正<v逆