题目内容
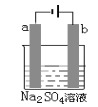
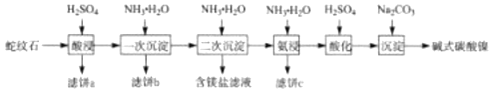
【题目】蛇纹石(含MgO、NiO、SiO2、Fe2O3、FeO等)因其外表青绿相问像蛇纹一样而得名。一种以蛇纹石为原料制取铁红和碱式碳酸镍[Ni3(OH)4CO34H2O]的流程如图:
已知:Ⅰ.该实验温度下,不同pH时铁沉淀物成分及热分解产物:
pH | 铁沉淀物成分 | 热分解产物 |
2.5 | NH4Fe3(SO4)2(OH)6 | Fe2O3,SO2,SO3,NH3,O2,H2O |
3.5 | α-FeOOH | Fe2O3,H2O |
Ⅱ.部分金属离子沉淀的pH:
Mg2+ | Fe2+ | Ni2+ | |
开始沉淀的pH | 9.4 | 6.5 | 6.7 |
沉淀完全的pH | 12.4 | 9.7 | 9.5 |
Ⅲ.“氨浸“后所得溶液中主要成分为[Ni(NH3)6]2+,且存在[Ni(NH3)6]2+ Ni2++6NH3请回答:
(1)滤饼a的主要成分为___。
(2)滤饼b经洗涤、煅烧可得铁红。则“一次沉淀”时应控制pH=__(填“2.5或“3.5”),其原因为___。
(3)“氨浸”时生成[Ni(NH3)6]2+的离子方程式为___;此过程会同时加入 NH4HCO3,其目的为___。
(4)“沉淀”前须先”酸化”,用平衡移动原理解释其原因为__。
(5)实验室测得Ni3(OH)4CO34H2O(M=377)样品在空气中受热时样品失重率(失重率=固体样品损失的总质量/起始加入样品的质量×100%)与温度(T)的关系如图所示。

①200oC时所得固体的化学式为___。
②250~350oC之间反应的化学方程式为___。
(6)碱式碳酸镍可进一步转化制得镍氢电池。镍氢电池的工作原理为:Ni(OH)2+M![]() NiOOH+MH(M表示储氢金属或合金)。该电池充电过程中阴极的电极反应式为___。
NiOOH+MH(M表示储氢金属或合金)。该电池充电过程中阴极的电极反应式为___。
【答案】SiO2 3.5 pH=3.5时,氧化铁产率高 Ni(OH)2+6NH3H2O=[Ni(NH3)6]2++2OH-+6H2O NH4++OH-NH3H2O,消耗OH-,有利于Ni(OH)2的溶解,HCO3-+OH-CO32-+H2O也消耗OH-,有利于Ni(OH)2的溶解,同时NH4++OH-NH3H2O,可以降低原料NH3H2O的用量 H+与NH3反应,促使[Ni(NH3)6]2+Ni2++6NH3正向移动,生成更多的Ni2+,有利于后续获得更多产品碱式碳酸镍 Ni3(OH)4CO3 Ni3(OH)4CO3![]() 3NiO+2H2O↑+CO2↑ M+H2O+e-=MH+OH-
3NiO+2H2O↑+CO2↑ M+H2O+e-=MH+OH-
【解析】
根据流程:蛇纹石(含MgO、NiO、SiO2、Fe2O3、FeO等)用硫酸酸浸,SiO2不溶,过滤得到含有Mg2+、Ni2+、Fe2+、Fe3+的溶液,滤饼a的主要成分为SiO2,加入氨水调节pH=3.5,得到沉淀α-FeOOH,经洗涤、煅烧可得铁红,滤液中加氨水调节pH沉淀Ni2+、Fe2+,过滤得到Ni(OH)2、Fe(OH)2,用氨水氨浸沉淀溶解Ni(OH)2,Ni(OH)2+6NH3H2O=[Ni(NH3)6]2++2OH-+6H2O,同时加入NH4HCO3促进Ni(OH)2的溶解,滤饼c为Fe(OH)2,将含有[Ni(NH3)6]2+的滤液用硫酸酸化得到Ni2+,再用碳酸钠沉淀得到Ni3(OH)4CO34H2O。
(1)SiO2不溶于硫酸,滤饼a的主要成分为SiO2;
(2)滤饼b经洗涤、煅烧可得铁红,由表可知,pH=3.5时,氧化铁产率高,故调节pH=3.5沉淀Fe3+;
(3)根据分析,“氨浸”时Ni(OH)2生成[Ni(NH3)6]2+,反应为:Ni(OH)2+6NH3H2O=[Ni(NH3)6]2++2OH-+6H2O;此过程会同时加入NH4HCO3,因为存在NH4++OH-NH3H2O,消耗OH-,有利于Ni(OH)2的溶解,HCO3-+OH-CO32-+H2O也消耗OH-,有利于Ni(OH)2的溶解,同时NH4++OH-NH3H2O,可以降低原料NH3H2O的用量;
(4)已知,“氨浸“后所得溶液中主要成分为[Ni(NH3)6]2+,且存在[Ni(NH3)6]2+Ni2++6NH3,加入硫酸酸化,H+与NH3反应,促使[Ni(NH3)6]2+Ni2++6NH3正向移动,生成更多的Ni2+,有利于后续获得更多产品碱式碳酸镍;
(5)①Ni3(OH)4CO34H2O(M=377)中,w(H2O)=![]() ×100%=19.1%,由图可知,200oC时,失重率=19.1%,说明样品失去结晶水,此时的固体物质为Ni3(OH)4CO3;
×100%=19.1%,由图可知,200oC时,失重率=19.1%,说明样品失去结晶水,此时的固体物质为Ni3(OH)4CO3;
②由图可知,250℃时物体为Ni3(OH)4CO3,300℃后固体物质不再变化,为镍的氧化物,设样品为1mol,300℃后,则根据镍元素守恒,最终的固体产物中含有3mol镍元素,此时固体物质的的质量为:377g-377g×(1-40.3%)=151.731g,其中n(O)=![]() =3,故n(Ni):n(O)=1:1,此时固体物质为NiO,故250~350oC之间反应的化学方程式为:Ni3(OH)4CO3
=3,故n(Ni):n(O)=1:1,此时固体物质为NiO,故250~350oC之间反应的化学方程式为:Ni3(OH)4CO3![]() 3NiO+2H2O↑+CO2↑;
3NiO+2H2O↑+CO2↑;
(6)镍氢电池的工作原理为:Ni(OH)2+M![]() NiOOH+MH,充电时阴极得电子发生还原反应,则为水中氢离子放电生成氢后被M储存,电极反应为:M+H2O+e-=MH+OH-。
NiOOH+MH,充电时阴极得电子发生还原反应,则为水中氢离子放电生成氢后被M储存,电极反应为:M+H2O+e-=MH+OH-。

【题目】根据下列实验操作和现象所得到的结论正确的是
选项 | 实验操作和现象 | 实验结论 |
A |
| 装置气密性良好 |
B | 将氧化铁加入到足量的HI溶液中,充分溶解后,滴加四氯化碳,震荡静置,下层呈紫红色。 | I2氧化性强与Fe3+ |
C | 往氢氧化铜沉淀中分别滴加盐酸和氨水,沉淀皆溶解 | 氢氧化铜为两性氢氧化物 |
D | 将SO2通入Na2CO3溶液中生成的气体,通入澄清石灰水中有浑浊 | 说明酸性:H2SO3﹥H2CO3 |
A.AB.BC.CD.D
【题目】温度为T时,在三个容积均为1L的恒容密闭容器中仅发生反应:2SO2(g)+O2(g)![]() 2SO3(g) ΔH<0,达到平衡时,下列说法不正确的是
2SO3(g) ΔH<0,达到平衡时,下列说法不正确的是
容器 编号 | 容器类型 | 起始物质的量 / mol | 平衡时SO3的物质的量 / mol | ||
SO2 | O2 | SO3 | |||
I | 恒温恒容 | 2 | 1 | 0 | 1.8 |
II | 恒温恒压 | 2 | 1 | 0 | a |
III | 绝热恒容 | 0 | 0 | 2 | b |
A. 容器I中SO2的转化率小于容器II中SO2的转化率
B. 容器II的平衡常数大于容器III中的平衡常数
C. 平衡时SO3的物质的量:a>1.8、b>1.8
D. 若起始时向容器I中充入0.10 mol SO2(g)、0.20mol O2(g)和2.0 mol SO3(g),则此时v正<v逆