题目内容
【题目】向硝酸酸化的2mL0.1molL-1AgNO3溶液(pH=2)中加入过量铁粉,振荡后静置,溶液先呈浅绿色,后逐渐呈粽黄色,试管底部仍存有黑色固体,过程中无气体生成。实验小组同学针对该实验现象进行如下探究。
Ⅰ.探究Fe2+产生的原因
(1)提出猜想:Fe2+可能是Fe与____或___反应的产物。
(2)实验探究:在两支试管中分别加入与上述实验等量的铁粉,再加入不同的液体试剂,5min后取上层清液,分别加入相同体积和浓度的铁氰化钾溶液
液体试剂 | 加人铁氰化钾溶液 | |
1号试管 | 2mL.0.1molL-1AgNO3溶液 | 无蓝色沉淀 |
2号试管 | ______ | 蓝色沉淀 |
①2号试管中所用的试剂为____。
②资料显示:该温度下,0.1molL-1的AgNO3溶液可以将Fe氧化为Fe2+。但1号试管中未观察到蓝色沉淀的原因可能为____。
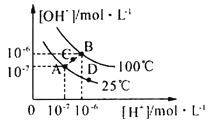
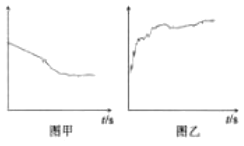
③小组同学继续进行实验,证明了2号试管得出的结论正确。实验如下:取100mL0.1molL-1硝酸酸化的AgNO3溶液(pH=2),加入铁粉井搅拌,分别插入pH传感器和NO3-传感器(传感器可检测离子浓度),得到如图图示,其中pH传感器测得的图示为___(填“图甲”或“图乙”)。
④实验测得2号试管中有NH4+生成,则2号试管中发生反应的离子方程式为___。
Ⅱ.探究Fe3+产生的原因
查阅资料可知,反应中溶液逐渐变棕黄色是因为Fe2+被Ag+氧化。小组同学设计不同实验方案对此进行验证。
(3)方案一;取出少量黑色固体,洗涤后___(填操作和现象),证明黑色固体中有Ag。
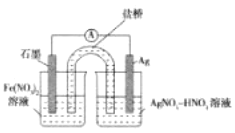
(4)方案二:按图连接装置,一段时间后取出左侧烧杯溶液,加人KSCN溶液,溶液变F红。该实验现象____(填“能“或“不能“)证明Fe2+可被Ag+氧化,理由为__。
【答案】HNO3 AgNO3 硝酸酸化的2mL0.1mol/LAgNO3的溶液(pH=2) 该反应速率很小或反应的活化能较大 图乙 NO3-+4Fe+10H+=NH4++4Fe2++3H2O 加入足量稀硝酸加热将固体全部溶解,再向所得溶液中加入稀盐酸,产生白色沉淀 不能 Fe2+可能被硝酸氧化或被氧气氧化
【解析】
(1)Fe过量,可能与硝酸反应生成硝酸亚铁,或Fe与硝酸银反应生成硝酸亚铁;
(2)①加硝酸酸化的2mL0.1mol/LAgNO3的溶液(pH=2)作对比实验;
②1号试管中未观察到蓝色沉淀,与反应速率很小有关;
③发生NO3-+4Fe+10H+=NH4++4Fe2++3H2O,消耗氢离子,pH增大;
④实验过程中,溶液先变成浅绿色,而后逐渐呈棕黄色,但整个过程中并无NO气体产生,则NO3-中N转化为NH4+;
(3)Ag可溶于硝酸,不溶于盐酸;
(4)左侧烧杯溶液,加KSCN溶液,溶液变红,可知左侧含铁离子,左侧为正极,但亚铁离子可能被硝酸或氧气氧化。
(1)提出猜想:Fe2+可能是Fe与HNO3或AgNO3反应的产物;
(2)①2号试管中所用的试剂为硝酸酸化的2mL0.1mol/LAgNO3的溶液(pH=2),与1为对比实验;
②资料显示:该温度下,0.1molL-1的AgNO3溶液可以将Fe氧化为Fe2+.但1号试管中未观察到蓝色沉淀的原因可能为该反应速率很小或反应的活化能较大;
③反应中消耗氢离子,pH变大,则pH传感器测得的图示为图乙;
④实验测得2号试管中有NH4+生成,则2号试管中发生反应的离子方程式为NO3-+4Fe+10H+=NH4++4Fe2++3H2O;
(3)方案一:取出少量黑色固体,洗涤后加入足量稀硝酸加热将固体全部溶解,再向所得溶液中加入稀盐酸,产生白色沉淀(或加入足量盐酸,有黑色固体剩余),证明黑色固体中有Ag;
(4)方案二:一段时间后取出左侧烧杯溶液,加入KSCN溶液,溶液变红,该实验现象不能证明Fe2+可被Ag+氧化,理由为Fe2+可能被硝酸氧化或被氧气氧化。

 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案【题目】温度为T时,在三个容积均为1L的恒容密闭容器中仅发生反应:2SO2(g)+O2(g)![]() 2SO3(g) ΔH<0,达到平衡时,下列说法不正确的是
2SO3(g) ΔH<0,达到平衡时,下列说法不正确的是
容器 编号 | 容器类型 | 起始物质的量 / mol | 平衡时SO3的物质的量 / mol | ||
SO2 | O2 | SO3 | |||
I | 恒温恒容 | 2 | 1 | 0 | 1.8 |
II | 恒温恒压 | 2 | 1 | 0 | a |
III | 绝热恒容 | 0 | 0 | 2 | b |
A. 容器I中SO2的转化率小于容器II中SO2的转化率
B. 容器II的平衡常数大于容器III中的平衡常数
C. 平衡时SO3的物质的量:a>1.8、b>1.8
D. 若起始时向容器I中充入0.10 mol SO2(g)、0.20mol O2(g)和2.0 mol SO3(g),则此时v正<v逆