题目内容
3.化学与生产、生活密切相关.下列叙述正确的是( )| A. | 煤的干馏和煤的液化均是物理变化 | |
| B. | 活性炭使糖浆脱色与次氯酸盐漂白纸浆的原理相同 | |
| C. | 海水淡化的方法有蒸馏法、电渗析法等 | |
| D. | 新型能源生物柴油和矿物油主要化学成分相同 |
分析 A.煤的干馏和煤的液化都是化学变化;
B.活性炭脱色是利用其吸附性;
C.海水淡化是指除去海水中的盐分以获得淡水的工艺过程(又称海水脱盐),其方法较多;
D.生物柴油是生物质能的一种,它是生物质利用热裂解等技术得到的一种长链脂肪酸的单烷基酯,矿物油的成分为多种烃混合物.
解答 解:A.煤的干馏是指将煤隔绝空气加强热使之分解的过程,煤液化生成甲醇,属于化学变化,故A错误;
B.活性炭脱色是利用其吸附性,次氯酸盐漂白是利用次氯酸的强氧化性,故D错误;
C.海水淡化是指除去海水中的盐分以获得淡水的工艺过程(又称海水脱盐),蒸馏是分离和提纯液态混合物常用的方法之一蒸馏法是人类最早使用的淡化海水的方法,技术和工艺比较完备;电渗析法是一种利用离子交换膜进行离子交换的方法,是近年发展起来的一种较好的海水淡化技术,原理为通电后,阴离子移向阳极,阳离子移向阴极,分离盐和水,故C正确;
D.生物柴油是指以油料作物、野生油料植物和工程微藻等水生植物油脂以及动物油脂、餐饮垃圾油等为原料油通过酯交换工艺制成的可代替石化柴油的再生性柴油燃料,是一种长链脂肪酸的单烷基酯,而矿物油的成分为多种烃混合物,两者成分不同,故D错误;
故选C.
点评 本题考查化学与生活、环境的关系,为高考常见考题,为理综中化学选择题首先出现的习题,涉及知识面较广,侧重分析与应用、化学与生活、环境等综合知识的考查,题目难度不大.

练习册系列答案
 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案
相关题目
5.下列说法正确的是( )
| A. | 将Ca(ClO)2、Na2SO3、FeCl3溶液蒸干可得到原溶质 | |
| B. | 因Cl2的氧化性强于I2的氧化性,所以置换反应I2+2NaClO3═2NaIO3+Cl2不能发生 | |
| C. | 在新制氯水中各微粒浓度的关系为:2c(Cl2)=c(ClO?)+c(Cl?)+c(HClO) | |
| D. | 用1L 0.2 mol•L-1NaOH溶液分别吸收0.1molSO2、0.1mol CO2,所得的两种溶液中酸根离子浓度大小关系是:c(SO32- )>c(CO32-)>c(HCO3-)>c(HSO3-) |
6.NA表示阿伏加德罗常数,下列叙述正确的是( )
| A. | 电解精炼铜的过程中,每转移NA个电子时,阳极溶解铜的质量为32g | |
| B. | 1 mol Na2O2固体中含离子总数为4NA | |
| C. | 1mol羟基与17 g NH3所含电子数之比为9:10 | |
| D. | 一定温度下,1 L 0.5 mol•L-1 NH4Cl溶液与2 L 0.25 mol•L-1 NH4Cl溶液含NH${\;}_{4}^{+}$的物质的量相同 |
3.用下列装置进行相应实验,能达到实验目的是( )
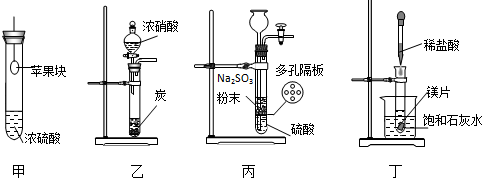

| A. | 用装置甲验证浓硫酸的脱水性和强氧化性 | |
| B. | 用装置乙验证浓硝酸的强氧化性 | |
| C. | 用装置丙制备SO2气体 | |
| D. | 用装置丁验证镁片与稀盐酸反应放热 |
10.某溶液可能含有Cl-、SO42-、CO32-、NH4+、Fe3+、Fe2+、Al3+ 和Na+.某同学为了确认其成分,取部分试液,设计并完成了如下实验:由此可知原溶液中( )
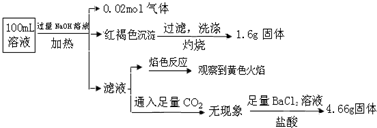

| A. | 溶液中至少有4种离子存在,其中Cl-一定存在,且c(Cl-)≥0.2 mol•L-1 | |
| B. | 原溶液中c(Fe3+)=0.2 mol•L-1 | |
| C. | SO42-、NH4+、Na+一定存在,CO32-、Al3+一定不存在 | |
| D. | 取少量原溶液并加入KSCN溶液,呈血红色,说明该溶液一定没有Fe2+,只有Fe3+ |
8.下列说法正确的是( )
| A. |  三种氨基酸脱水,最多可生成6种二肽 三种氨基酸脱水,最多可生成6种二肽 | |
| B. | 戊烷、戊醇、戊烯、乙酸乙酯中同分异构体数目最少的是戊烯 | |
| C. | 分子式为C5H12O且可与金属钠反应放出氢气的有机化合物有8种 | |
| D. | 将2-丙醇与NaOH的醇溶液共热可制备CH3-CH=CH2 |
15.分子式为C5H10O2的羧酸和酯且有3个甲基的同分异构体共有(不考虑立体异构)( )
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
12.已知反应O2(g)+2Cl2(g)?2Cl2O(g);△H>0.在三个恒温、恒容的密闭容器中分别充入1mol O2与2 mol Cl2,测得平衡时O2的转化率如下表:下列说法正确的是( )
| 容器编号 | 温度/℃ | 容器体积/L | 平衡时O2转化率 | 平衡时压强/Pa |
| ① | 200 | V1 | 50% | p1 |
| ② | 200 | V2 | 70% | p2 |
| ③ | 350 | V3 | 50% | p3 |
| A. | 起始反应速率:③>①>② | |
| B. | 平衡时压强:p1<p2 | |
| C. | 容器体积:V1<V3 | |
| D. | 若实验②中O2和Cl2用量均加倍,则平衡时O2的转化率小于70% |
13.X、Y、Z、W是元素周期表前四周期中常见的元素,原子序数依次增大,其相关信息如表:
(1)W位于元素周期表第四周期第IB族,W的基态原子核外电子排布式为:1s22s22p63s23p63d104s1.
(2)Y的第一电离能比Z的大(填“大”或者“小”),YX3与X2Z的分子中存在的σ键之比为3:2,Y的简单氢化物在水中有惊人的溶解度,解释其原因NH3与H2O分子之间形成氢键.
(3)Y2X4与WZ在加热条件下制得W单质,写出化学方程式并标出电子转移的方向与数目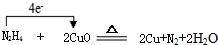 .
.
| 元素 | 相关信息 |
| X | 由X形成的单质是最清洁的能源 |
| Y | Y的基态原子核外P能级电子数比S能级少一个 |
| Z | 由Z形成的多种单质,其中之一是地球的“保护伞” |
| W | W的基态原子核外最外层只有1个电子,是人类社会最早使用的货币金属 |
(2)Y的第一电离能比Z的大(填“大”或者“小”),YX3与X2Z的分子中存在的σ键之比为3:2,Y的简单氢化物在水中有惊人的溶解度,解释其原因NH3与H2O分子之间形成氢键.
(3)Y2X4与WZ在加热条件下制得W单质,写出化学方程式并标出电子转移的方向与数目
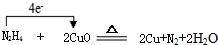 .
.