题目内容
8.下列说法正确的是( )| A. |  三种氨基酸脱水,最多可生成6种二肽 三种氨基酸脱水,最多可生成6种二肽 | |
| B. | 戊烷、戊醇、戊烯、乙酸乙酯中同分异构体数目最少的是戊烯 | |
| C. | 分子式为C5H12O且可与金属钠反应放出氢气的有机化合物有8种 | |
| D. | 将2-丙醇与NaOH的醇溶液共热可制备CH3-CH=CH2 |
分析 A.三种氨基酸脱水,可在相同氨基酸或不同氨基酸之间生成二肽;
B.戊烷只存在碳链异构,同分异构体为3种,而戊醇和戊烯存在碳链异构、位置异构,乙酸乙酯存在碳链异构、官能团异构、位置异构,异构类型越多,同分异构体的数目越多;
C.分子式为C5H12O且可与金属钠反应放出氢气的有机物为醇;
D.将2-丙醇和浓硫酸混合加热制取丙烯.
解答 解;A.三种氨基酸脱水,生成二肽种类=3+3×2=9,故A错误;
B.戊烷只存在碳链异构,同分异构体为3种,戊醇、戊烯、乙酸乙酯存在碳链异构、位置异构,异构类型越多,同分异构体的数目越多,因此同分异构体数目均大于3种,所以戊烷的同分异构体数目最少,故B错误;
C.分子式为C5H12O且可与金属钠反应放出氢气的有机物为醇,有1-戊醇、2-戊醇、3-戊醇、2-甲基-1-丁醇、2-甲基-2-丁醇、3-甲基-2-丁醇、3-甲基-1-丁醇、2,2-二甲基-1-丙醇,所以有8种同分异构体,故C正确;
D.将2-丙醇和浓硫酸混合加热制取丙烯,卤代烃和氢氧化钠的醇溶液发生消去反应生成烯烃,故D错误.
故选C.
点评 本题考查有机物结构和性质、同分异构体种类判断,为高考高频点,明确物质中官能团及其性质关系是解本题关键,难点是同分异构体种类判断,要考虑官能团异构、碳链异构、位置异构.

练习册系列答案
相关题目
11.NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,22.4 L二氯甲烷的分子数约为NA个 | |
| B. | 盛有SO2的密闭容器中含有NA个氧原子,则SO2的物质的量为0.5 mol | |
| C. | 17.6 g丙烷中所含的极性共价键为6.4 NA个 | |
| D. | 电解精炼铜时,若阴极得到的电子数为2 NA个,则阳极质量减少64 g |
8.下列关于Fe3+、Fe2+性质实验的说法错误的是( )
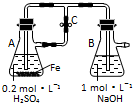

| A. | 用如图装置可以制备沉淀Fe(OH)2 | |
| B. | 配制FeCl3溶液时,先将氯化铁晶体溶于较浓的盐酸中,再加水稀释到所需要的浓度 | |
| C. | FeCl3溶液中滴加KSCN溶液会生成红色沉淀 | |
| D. | 向FeCl2溶液中加入少量铁粉是为了防止Fe2+被氧化 |
3.化学与生产、生活密切相关.下列叙述正确的是( )
| A. | 煤的干馏和煤的液化均是物理变化 | |
| B. | 活性炭使糖浆脱色与次氯酸盐漂白纸浆的原理相同 | |
| C. | 海水淡化的方法有蒸馏法、电渗析法等 | |
| D. | 新型能源生物柴油和矿物油主要化学成分相同 |
13.有关下列装置或操作的说法正确的是( )
| A. | 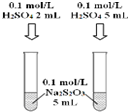 可以探究H2SO4浓度对反应速率的影响 | |
| B. | 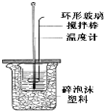 用于测定中和热时应该用稍过量的NaOH溶液和盐酸反应 | |
| C. | 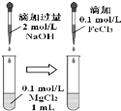 可以探究Mg(OH)2能否转化成Fe(OH)3 | |
| D. | 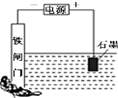 中金属防护方法叫做牺牲阳极的阴极保护法 |
17.下列现象说法正确的是( )
| A. | 红热的铁丝在氯气中燃烧产生棕色的烟雾 | |
| B. | 含有氯元素的物质都呈黄绿色 | |
| C. | 氢气在氯气中燃烧时火焰呈淡蓝色,在瓶口有白雾产生 | |
| D. | 钠在空气里加热,先熔成小球,剧烈燃烧,产生黄色火焰,生成淡黄色固体 |
18.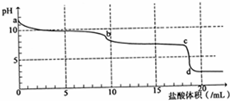 常温下,用0.2mol•L-1HCl溶液滴定10mL浓度为0.2mol•L-1 Na2CO3溶液,所得滴定曲线如图所示.下列说法不正确的是( )
常温下,用0.2mol•L-1HCl溶液滴定10mL浓度为0.2mol•L-1 Na2CO3溶液,所得滴定曲线如图所示.下列说法不正确的是( )
 常温下,用0.2mol•L-1HCl溶液滴定10mL浓度为0.2mol•L-1 Na2CO3溶液,所得滴定曲线如图所示.下列说法不正确的是( )
常温下,用0.2mol•L-1HCl溶液滴定10mL浓度为0.2mol•L-1 Na2CO3溶液,所得滴定曲线如图所示.下列说法不正确的是( )| A. | a点时:c(H+)+c(HCO3-)+2c(H2CO3)=c(OH-) | |
| B. | 当盐酸加入5mL时:c(CO32-)+c(HCO3-)+c(H2CO3)=2c(Cl-) | |
| C. | 当盐酸加入10mL时:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) | |
| D. | b-c段发生的反应为:HCO3-+H+=CO2↑+H2O |

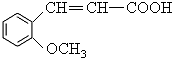 .
.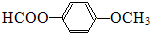 、
、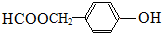 或
或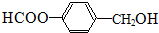 (任写一种).
(任写一种).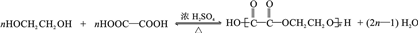 .
.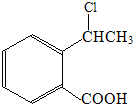 为原料制
为原料制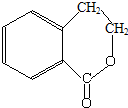 的合成路线流程图(无机试剂任用),在方框中填出相应的物质,并在括号注明反应条件.合成路线流程图示例如图2:
的合成路线流程图(无机试剂任用),在方框中填出相应的物质,并在括号注明反应条件.合成路线流程图示例如图2: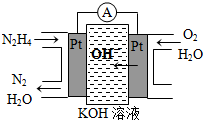 肼(N2H4)又称联氨,广泛用于火箭推进剂、有机合成及燃料电池,NO2的二聚体N2O4则是火箭中常用氧化剂.试回答下列问题
肼(N2H4)又称联氨,广泛用于火箭推进剂、有机合成及燃料电池,NO2的二聚体N2O4则是火箭中常用氧化剂.试回答下列问题