题目内容
3.用下列装置进行相应实验,能达到实验目的是( )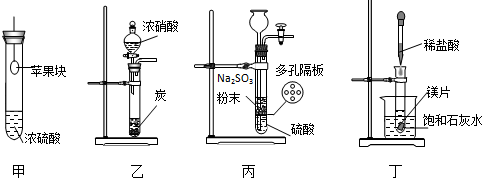
| A. | 用装置甲验证浓硫酸的脱水性和强氧化性 | |
| B. | 用装置乙验证浓硝酸的强氧化性 | |
| C. | 用装置丙制备SO2气体 | |
| D. | 用装置丁验证镁片与稀盐酸反应放热 |
分析 A.如苹果块不进入浓硫酸中,则不能验证脱水性和强氧化性;
B.应在加热条件下进行;
C.亚硫酸钠易溶于水,不能用简易气体发生装置控制;
D.如烧杯内有晶体析出,则说明反应放热.
解答 解:A.苹果块悬在浓硫酸上方,不能验证脱水性和强氧化性,如苹果块变干,可说明浓硫酸的吸水性,故A错误;
B.常温下不反应或反应较慢,应在加热条件下进行,故B错误;
C.亚硫酸钠易溶于水,不能用简易气体发生装置制备气体并控制,故C错误;
D.氢氧化钙溶解度随温度升高而降低,如烧杯内有晶体析出,则说明反应放热,故D正确.
故选D.
点评 本题考查化学实验方案的评价,为高频考点,把握实验原理及实验装置的作用为解答的关键,明确实验基本操作和物质的性质即可解答,注意实验的评价性和操作性分析,题目难度不大.

练习册系列答案
相关题目
13.电解NO制备NH4NO3,其工作原理如图所示,下列说法不正确的是( )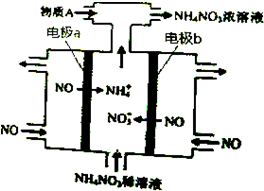

| A. | b极的电极反应为:NO-3e-+2H2O=NO3-+4H+ | |
| B. | 溶液中的H+由电极a处向电极b处迁移 | |
| C. | 电解过程总反应的化学方程式为:8NO+7H2O$\frac{\underline{\;通电\;}}{\;}$3NH4NO3+2HNO3 | |
| D. | 为使电解产物全部转化为NH4NO3,需补充的物质A是NH3 |
11.NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,22.4 L二氯甲烷的分子数约为NA个 | |
| B. | 盛有SO2的密闭容器中含有NA个氧原子,则SO2的物质的量为0.5 mol | |
| C. | 17.6 g丙烷中所含的极性共价键为6.4 NA个 | |
| D. | 电解精炼铜时,若阴极得到的电子数为2 NA个,则阳极质量减少64 g |
8.下列关于Fe3+、Fe2+性质实验的说法错误的是( )
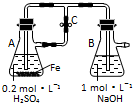

| A. | 用如图装置可以制备沉淀Fe(OH)2 | |
| B. | 配制FeCl3溶液时,先将氯化铁晶体溶于较浓的盐酸中,再加水稀释到所需要的浓度 | |
| C. | FeCl3溶液中滴加KSCN溶液会生成红色沉淀 | |
| D. | 向FeCl2溶液中加入少量铁粉是为了防止Fe2+被氧化 |
3.化学与生产、生活密切相关.下列叙述正确的是( )
| A. | 煤的干馏和煤的液化均是物理变化 | |
| B. | 活性炭使糖浆脱色与次氯酸盐漂白纸浆的原理相同 | |
| C. | 海水淡化的方法有蒸馏法、电渗析法等 | |
| D. | 新型能源生物柴油和矿物油主要化学成分相同 |
1.由环已烷、乙醇、乙醚(C4H10O)组成的混和物,经测定其中碳的质量分数为72%,则氧的质量分数为( )
| A. | 14.2% | B. | 16% | C. | 17.8% | D. | 19.4% |

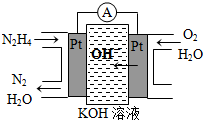 肼(N2H4)又称联氨,广泛用于火箭推进剂、有机合成及燃料电池,NO2的二聚体N2O4则是火箭中常用氧化剂.试回答下列问题
肼(N2H4)又称联氨,广泛用于火箭推进剂、有机合成及燃料电池,NO2的二聚体N2O4则是火箭中常用氧化剂.试回答下列问题