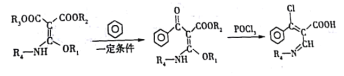
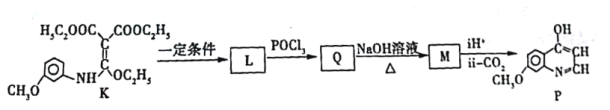
题目内容
【题目】中药麻黄成分中含有生物碱、黄酮、鞣质、挥发油、有机酚、多糖等许多成分,其中一种有机酚的结构简式如图。下列说法正确的是( )
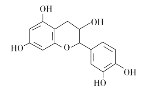
A.分子中所有碳原子可以处于同一平面
B.分子中含有2个手性原子
C.1mol该有机物跟足量浓溴水反应,最多消耗5molBr2
D.1mol该有机物与NaOH溶液反应最多消耗5molNaOH
【答案】BC
【解析】
A.分子中两个苯环之间连有3个饱和碳原子类似于甲烷中碳的结构,则所有碳原子不可能处于同一平面,A选项错误;
B.由结构简式分析可知,该分子的中间六元环连接羟基的碳原子和连接醚键的碳原子均为手性碳原子,即该分子中含有2个手性碳原子,B选项正确;
C.1 mol该有机物跟足量浓溴水发生取代反应,酚羟基邻位、对位的苯环氢被取代,最多消耗5 mol Br2,C选项正确;
D.有机物中含有的4个酚羟基与NaOH反应,1 mol该有机物与NaOH溶液反应最多消耗4 mol NaOH,D选项错误;
答案选BC。

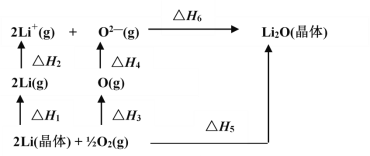
【题目】铍铜是广泛应用于制造高级弹性元件的良好合金。某科研小组从某旧铍铜元件(含25%BeO、71%CuS、少量FeS和SiO2)中回收铍和铜两种金属的工艺流程如图:

已知:Ⅰ.铍、铝元素的化学性质相似,单质铍与氢氧化钠溶液反应生成可溶于水的Na2BeO2
Ⅱ.常温下部分难溶物的溶度积常数如下表:
难溶物 | Cu(OH)2 | Fe(OH)3 | Mn(OH)2 |
溶度积常数(Ksp) | 2.2×10-20 | 4.0×10-38 | 2.1×10-13 |
(1)滤液A的主要成分除NaOH外,还有___(填化学式),写出反应I中含铍化合物与过量盐酸反应的离子方程式:___。
(2)滤液C中含NaCl、BeCl2和少量HCl,为提纯BeCl2,最合理的实验步骤顺序为___(填字母)。
a.加入过量的氨水
b.通入过量的CO2
c.加入过量的NaOH
d.加入适量的HCl
e.洗涤
f.过滤
(3)①MnO2能将金属硫化物中的硫元素氧化为硫单质。写出反应Ⅱ中CuS发生反应的化学方程式:___。
②若用浓HNO3溶解金属硫化物,缺点是___(任写一条)。
(4)滤液D中c(Cu2+)=2.2mol·L-1、c(Fe3+)=0.008mol·L-1、c(Mn2+)=0.01mol·L-1,逐滴加入稀氨水调节pH可将其依次分离,首先沉淀的是___(填离子符号),为使铜离子开始沉淀,常温下应调节溶液的pH大于___。
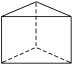
(5)电解NaCl-BeCl2混合熔盐可制备金属铍,如图是电解装置图。
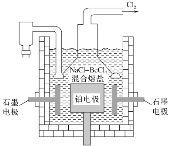
①石墨电极上的电极反应式为___。
②电解得到的Be蒸气中约含1%的Na蒸气,除去Be中少量Na的方法为___。
已知部分物质的熔、沸点如下表:
物质 | 熔点(K) | 沸点(K) |
Be | 1551 | 3243 |
Na | 370 | 1156 |
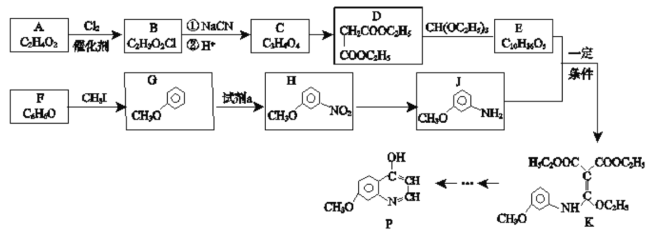
【题目】硫酸镍是电镀工业必不可少的化工原料。从不锈钢废渣(主要含Fe42.35%、Cr9.67%、Ni5.1%、C4.7%、Si3.39%等)中制取硫酸镍晶体的工艺流程如图:
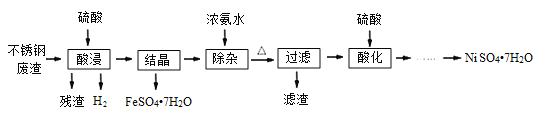 已知:①Cr3+与氨水反应时有少量Cr3+生成[Cr(NH3)6]3+,但加热时该络合物易分解。Ni2+与氨水反应生成[Ni(NH3)6]2+,该络合物加热时稳定,用硫酸酸化时生成相应的硫酸盐。
已知:①Cr3+与氨水反应时有少量Cr3+生成[Cr(NH3)6]3+,但加热时该络合物易分解。Ni2+与氨水反应生成[Ni(NH3)6]2+,该络合物加热时稳定,用硫酸酸化时生成相应的硫酸盐。
②Na2CrO4溶液中加酸调节pH为3.5时,CrO42-转化为Cr2O72-。
③相关物质在不同温度时溶解度如下表:
温度 溶解度/g 物质 | 20℃ | 30℃ | 40℃ | 60℃ | 80℃ | 90℃ |
Na2SO4 | 19.5 | 40.8 | 48.8 | 45.3 | 43.7 | 42.7 |
Na2Cr2O7 | 183 | 198 | 215 | 269 | 376 | 405 |
(1)“酸浸”后得到的溶液中主要含有FeSO4、NiSO4、Cr2(SO4)3,生成NiSO4的化学方程式为___。“酸浸”时需控制温度为90℃左右,可以采用的加热方式是___。
(2)“过滤”前,适当加热的目的是___。
(3)对“过滤”所得的滤渣进行洗涤,检验滤渣已洗涤干净的方法是___。
(4)“过滤”时产生的滤渣可用于制备Na2Cr2O7晶体。
①滤渣经干燥后与Na2CO3混合在空气中煅烧生成Na2CrO4和CO2,此反应的化学方程式为___。
②请补充完整上述煅烧后混合物制备Na2Cr2O7晶体(橙红色)的实验方案:水浸,过滤,___,烘干得Na2Cr2O7晶体(必须使用的试剂有:硫酸,蒸馏水)。