题目内容
【题目】硫酸镍是电镀工业必不可少的化工原料。从不锈钢废渣(主要含Fe42.35%、Cr9.67%、Ni5.1%、C4.7%、Si3.39%等)中制取硫酸镍晶体的工艺流程如图:
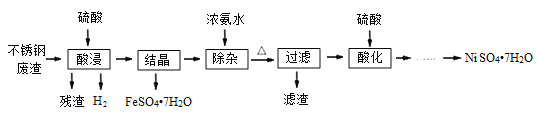 已知:①Cr3+与氨水反应时有少量Cr3+生成[Cr(NH3)6]3+,但加热时该络合物易分解。Ni2+与氨水反应生成[Ni(NH3)6]2+,该络合物加热时稳定,用硫酸酸化时生成相应的硫酸盐。
已知:①Cr3+与氨水反应时有少量Cr3+生成[Cr(NH3)6]3+,但加热时该络合物易分解。Ni2+与氨水反应生成[Ni(NH3)6]2+,该络合物加热时稳定,用硫酸酸化时生成相应的硫酸盐。
②Na2CrO4溶液中加酸调节pH为3.5时,CrO42-转化为Cr2O72-。
③相关物质在不同温度时溶解度如下表:
温度 溶解度/g 物质 | 20℃ | 30℃ | 40℃ | 60℃ | 80℃ | 90℃ |
Na2SO4 | 19.5 | 40.8 | 48.8 | 45.3 | 43.7 | 42.7 |
Na2Cr2O7 | 183 | 198 | 215 | 269 | 376 | 405 |
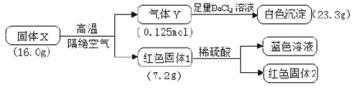
(1)“酸浸”后得到的溶液中主要含有FeSO4、NiSO4、Cr2(SO4)3,生成NiSO4的化学方程式为___。“酸浸”时需控制温度为90℃左右,可以采用的加热方式是___。
(2)“过滤”前,适当加热的目的是___。
(3)对“过滤”所得的滤渣进行洗涤,检验滤渣已洗涤干净的方法是___。
(4)“过滤”时产生的滤渣可用于制备Na2Cr2O7晶体。
①滤渣经干燥后与Na2CO3混合在空气中煅烧生成Na2CrO4和CO2,此反应的化学方程式为___。
②请补充完整上述煅烧后混合物制备Na2Cr2O7晶体(橙红色)的实验方案:水浸,过滤,___,烘干得Na2Cr2O7晶体(必须使用的试剂有:硫酸,蒸馏水)。
【答案】Ni+H2SO4=NiSO4+H2↑ 90℃水浴加热 使[Cr(NH3)6]3+分解生成Cr(OH)3沉淀 取少量最后一次洗涤液于试管中,加入BaCl2溶液,若无沉淀生成,则已洗净 4Cr(OH)3+4Na2CO3+3O2![]() 4Na2CrO4+4CO2+6H2O 向滤液中加入硫酸调节pH至3.5,将溶液加热到90℃(以上)蒸发结晶,至有少量橙红色晶体析出时趁热过滤,滤液降温至40℃结晶,过滤,用蒸馏水洗涤,干燥,得Na2Cr2O7晶体
4Na2CrO4+4CO2+6H2O 向滤液中加入硫酸调节pH至3.5,将溶液加热到90℃(以上)蒸发结晶,至有少量橙红色晶体析出时趁热过滤,滤液降温至40℃结晶,过滤,用蒸馏水洗涤,干燥,得Na2Cr2O7晶体
【解析】
由工艺流程图分析可知,从不锈钢废渣(主要含Fe 42.35%、Cr 9.67%、Ni 5.1%、C 4.7%、Si 3.39%等),由实验流程可知,硫酸溶解分离出残渣为Si、C,“酸浸”后得到的溶液中主要含有FeSO4、NiSO4、Cr2(SO4)3,然后结晶分离出绿矾,结晶信息可知加氨水生成[Cr(NH3)6]3+,但加热时该络合物易分解,而Ni2+与氨水反应生成[Ni(NH3)6]2+,该络合物加热时稳定,过滤分离出[Ni(NH3)6]2+,用硫酸酸化时生成NiSO4,蒸发浓缩、冷却结晶、过滤分离出硫酸镍晶体,以此来解答。
根据上述分析可知:
(1)生成NiSO4的化学方程式为Ni+H2SO4═NiSO4+H2↑,“酸浸”时需控制温度为90℃左右,可以采用的加热方式是90℃水浴加热,故答案为:Ni+H2SO4═NiSO4+H2↑;90℃水浴加热;
(2)“过滤”前,适当加热的目的是使[Cr(NH3)6]3+分解生成Cr(OH)3沉淀,故答案为:使[Cr(NH3)6]3+分解生成Cr(OH)3沉淀;
(3)对“过滤”所得的滤渣进行洗涤,检验滤渣已洗涤干净的方法是检验是否含有硫酸根离子,即取少量最后一次洗涤过滤液于试管中,先用盐酸酸化,再加入BaCl2溶液,若无沉淀生成,则已洗净,故答案为:取少量最后一次洗涤过滤液于试管中,先用盐酸酸化,再加入BaCl2溶液,若无沉淀生成,则已洗净;
(4)①滤渣经干燥后与Na2CO3混合在空气中煅烧生成Na2CrO4和CO2,此反应的化学方程式为4Cr(OH)3+4Na2CO3+3O2![]() 4Na2CrO4+4CO2+6H2O,故答案为:4Cr(OH)3+4Na2CO3+3O2
4Na2CrO4+4CO2+6H2O,故答案为:4Cr(OH)3+4Na2CO3+3O2![]() 4Na2CrO4+4CO2+6H2O;
4Na2CrO4+4CO2+6H2O;
②根据题干信息可知制备Na2Cr2O7晶体(橙红色)的实验方案:水浸,过滤,向滤液中加入硫酸调节pH至3.5,将溶液加热到90℃(以上)蒸发结晶,有大量无色晶体析出,至有少量橙红色晶体析出时趁热过滤,滤液降温至40℃结晶,过滤,用蒸馏水洗涤,干燥,得Na2Cr2O7晶体。

 浙江名校名师金卷系列答案
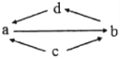
浙江名校名师金卷系列答案【题目】下表所列各组物质中,物质之间通过一步反应无法实现如图所示转化的是( )
物质转化关系 | a | b | c | d | |
A |
| FeCl2 | FeCl3 | Fe | CuCl2 |
B | SO2 | SO3 | S | H2SO4 | |
C | CH2ClCH2Cl | CH≡CH | CH2OHCH2OH | CH2=CH2 | |
D | Al2O3 | NaAlO2 | Al | Al(OH)3 |
A. AB. BC. CD. D