题目内容
【题目】对可逆反应4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g),下列叙述中正确的是( )
4NO(g)+6H2O(g),下列叙述中正确的是( )
A.达到化学平衡时4υ正(O2)=5υ逆(NO)
B.若单位时间内生成xmolNO的同时,消耗xmolNH3,则反应达平衡状态
C.达到化学平衡时,若升高温度,则正反应速率减小,逆反应速率增大
D.平衡时混合物中可能各物质的浓度相等,且保持不变
【答案】AD
【解析】
A.达到平衡时υ正(O2)= υ逆(O2),而4υ逆(O2)= 5υ逆(NO),所以4υ正(O2)=5υ逆(NO),故A正确;
B.生成NO和消耗NH3均为正反应,无论反应是否达到平衡状态,单位时间内生成xmolNO的同时就会消耗xmolNH3,故B错误;
C.升高温度,正、逆反应速率均增大,故C错误;
D.可逆反应达到平衡时各物质的浓度不变,由于该反应的初始投料和转化率均未知,所以达到平衡时,混合物中可能各物质的浓度相等,故D正确;
故答案为AD。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
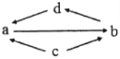
【题目】下表所列各组物质中,物质之间通过一步反应无法实现如图所示转化的是( )
物质转化关系 | a | b | c | d | |
A |
| FeCl2 | FeCl3 | Fe | CuCl2 |
B | SO2 | SO3 | S | H2SO4 | |
C | CH2ClCH2Cl | CH≡CH | CH2OHCH2OH | CH2=CH2 | |
D | Al2O3 | NaAlO2 | Al | Al(OH)3 |
A. AB. BC. CD. D