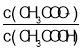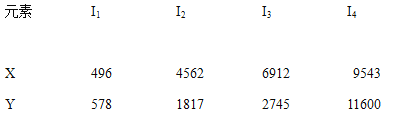��Ŀ����
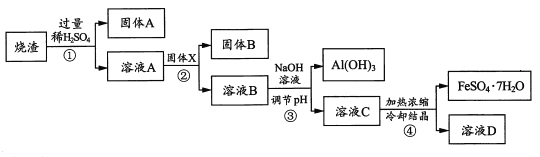
����Ŀ����ͭ�ǹ㷺Ӧ�������������Ԫ�������úϽ�ij����С���ij����ͭԪ��(��25%BeO��71%CuS������FeS��SiO2)�л������ͭ���ֽ����Ĺ���������ͼ��

��֪����.�롢��Ԫ�صĻ�ѧ�������ƣ�������������������Һ��Ӧ���ɿ�����ˮ��Na2BeO2
��.�����²�����������ܶȻ��������±���
������ | Cu(OH)2 | Fe(OH)3 | Mn(OH)2 |
�ܶȻ�����(Ksp) | 2.2��10-20 | 4.0��10-38 | 2.1��10-13 |
��1����ҺA����Ҫ�ɷֳ�NaOH�⣬����___(�ѧʽ)��д����ӦI�к��뻯������������ᷴӦ�����ӷ���ʽ��___��
��2����ҺC�к�NaCl��BeCl2������HCl��Ϊ�ᴿBeCl2���������ʵ�鲽��˳��Ϊ___(����ĸ)��
a.��������İ�ˮ
b.ͨ�������CO2
c.���������NaOH
d.����������HCl
e.ϴ��
f.����
��3����MnO2�ܽ����������е���Ԫ������Ϊ���ʡ�д����Ӧ����CuS������Ӧ�Ļ�ѧ����ʽ��___��
������ŨHNO3�ܽ�������ȱ����___(��дһ��)��
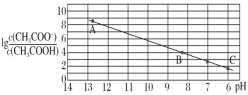
��4����ҺD��c(Cu2+)=2.2mol��L-1��c(Fe3+)=0.008mol��L-1��c(Mn2+)=0.01mol��L-1����μ���ϡ��ˮ����pH�ɽ������η��룬���ȳ�������___(�����ӷ���)��Ϊʹͭ���ӿ�ʼ������������Ӧ������Һ��pH����___��
��5�����NaCl-BeCl2������ο��Ʊ������룬��ͼ�ǵ��װ��ͼ��
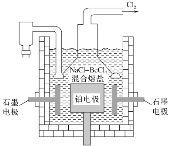
��ʯī�缫�ϵĵ缫��ӦʽΪ___��
�ڵ��õ���Be������Լ��1%��Na��������ȥBe������Na�ķ���Ϊ___��
��֪�������ʵ��ۡ��е����±���
���� | �۵�(K) | �е�(K) |
Be | 1551 | 3243 |
Na | 370 | 1156 |
���𰸡�Na2BeO2��Na2SiO3 BeO22-+4H+=Be2++2H2O afed MnO2+CuS+2H2SO4=MnSO4+S+CuSO4+2H2O ������Ⱦ���������� Fe3+ 4 Be2++2e-=Be �����¶�1156��3243K֮����ȴ
��������
����ɹ�������ͼ������֪���Ͼ���ͭԪ��(��BeO��25%��CuS��71%������FeS��SiO2)��������������Һ���˵õ���ҺAΪNaOH��Na2SiO3��Na2BeO2����ҺA�м������������˵õ�����Ϊ���ᣬ��ҺC��ҪΪ��NaCl��BeCl2������HCl����������İ�ˮ���ˣ�ϴ�Ӽ���������HCl �õ��Ȼ�����Һ������Ũ����ȴ�ᾧ�õ����壬һ�������·�Ӧ�õ��룬����B�м���������̵�ϡ���ᷢ����ӦMnO2�ܽ����������е���Ԫ������Ϊ���ʣ����˵õ��������ҺD����ҺD�к�c(Cu2+)��c(Fe3+)��c(Mn2+)����μ���ϡ��ˮ����pH�����η��룬���һϵ�в����õ�ͭ��
(1)��������������֪����ҺA����Ҫ�ɷֳ�NaOH�⣬����Na2BeO2��Na2SiO3����ӦI�к��뻯������������ᷴӦ�����ӷ���ʽΪBeO22-+4H+=Be2++2H2O���ʴ�Ϊ��Na2BeO2��Na2SiO3��BeO22-+4H+=Be2++2H2O��
(2)����ҺC�к�NaCl��BeCl2������HCl��Ϊ�ᴿBeCl2���������ʵ�鲽��˳��Ϊafed����������İ�ˮ�к����ᡢ����Be2+��Ȼ����ˡ�ϴ�ӳ�����������������HCl�������ܽ⼴�ɣ��ʴ�Ϊ��afed��
(3)��MnO2�ܽ����������е���Ԫ������Ϊ���ʣ���ˣ���Ӧ����CuS������Ӧ�Ļ�ѧ����ʽΪCuS+MnO2+2H2SO4=CuSO4+MnSO4+S+2H2O���ʴ�Ϊ��CuS+MnO2+2H2SO4=CuSO4+MnSO4+S+2H2O��
������HNO3�������Ժ�ǿ���ڷ�Ӧ�л��������������Կ��������Ⱦ���������Dz�ѡ��Ũ���ᣬ�ʴ�Ϊ���������Ⱦ���������壻
(4)��ҺD��c(Cu2+)=2.2mol��L��1��c(Fe3+)=0.008mol��L��1��c(Mn2+)=0.01mol��L��1����μ���ϡ��ˮ����pH�ɽ������η��롣Cu2+��ʼ����ʱ��c(OH-)=![]() mol/L=10-10mol/L��pH=4��Fe3+��ʼ����ʱ��c(OH-)=
mol/L=10-10mol/L��pH=4��Fe3+��ʼ����ʱ��c(OH-)=![]() mol/L=
mol/L=![]() mol/L��Mn2+��ʼ����ʱ��c(OH-)=
mol/L��Mn2+��ʼ����ʱ��c(OH-)=![]() mol/L��1.45��10-5mol/L����ˣ����ȳ�������Fe3+��Ϊʹͭ���ӿ�ʼ������������Ӧ������Һ��pH����4���ʴ�Ϊ��Fe3+��4��
mol/L��1.45��10-5mol/L����ˣ����ȳ�������Fe3+��Ϊʹͭ���ӿ�ʼ������������Ӧ������Һ��pH����4���ʴ�Ϊ��Fe3+��4��
(5)��ʯī�缫���ɽ���Be���缫��Ӧ����ʽΪ��Be2++2e-=Be���ʴ�ΪBe2++2e-=Be��
��ͼ����Ϣ��֪Na��Be���۷е���ܴ���Na������Be�������Կ����¶�1156~3243K֮����ȴ���ʴ�Ϊ���Կ����¶�1156~3243K֮����ȴ��

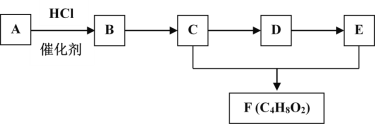
 ����ͬ�����Ծ�ϵ�д�
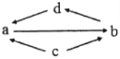
����ͬ�����Ծ�ϵ�д�����Ŀ���±����и��������У�����֮��ͨ��һ����Ӧ��ʵ����ͼ��ʾת������( )
����ת����ϵ | a | b | c | d | |
A |
| FeCl2 | FeCl3 | Fe | CuCl2 |
B | SO2 | SO3 | S | H2SO4 | |
C | CH2ClCH2Cl | CH��CH | CH2OHCH2OH | CH2=CH2 | |
D | Al2O3 | NaAlO2 | Al | Al(OH)3 |
A. AB. BC. CD. D