题目内容
【题目】常温时,已知部分弱酸的电离平衡常数如下表:
弱酸 | CH3COOH | H2S | H2CO3 | H2SO3 |
电离平衡常数(25 ℃) | K=10-5 | K1=1.3×10 -7 K2=7.1×10 -15 | K1=4.4×10 -7 K2=4.7×10 -11 | K1=1.3×10 -2 K2=6.3×10 -8 |
请回答下列问题:
(1)H2S 的第二级电离平衡常数的表达式 K2=______
(2)25℃时,若 CH3COOH 的起始浓度为 0.1 mol·L -1,则平衡时 c(H+)=____mol/L,由水电离的出的 c(H+)=____mol/L。
(3)(A)相同浓度的①CH3COONa 溶液、②Na2CO3溶液、③Na2S溶液、④NaHSO3溶液和⑤Na2SO3溶液,pH 由大到小排序为________(用序号表示)
(B)纯碱可代替洗涤剂洗涤餐具,原因是(用离子方程式表示)___________
(4)pH 均为 5硫酸和醋酸两份溶液,把硫酸溶液稀释 1000 倍,则 c(H+)/c(SO42-)=___;把醋酸稀释 100 倍,pH 范围为_____
(5)将少量H2S气体通入到 Na2CO3溶液中发生反应的离子方程式为______
【答案】(H+)(S2-)/(HS-) 0.001 10-11 ③②⑤①④ CO32-+H2O![]() HCO3-+OH- 2:1 5<pH<7 H2S+CO32-===HCO3-+HS-
HCO3-+OH- 2:1 5<pH<7 H2S+CO32-===HCO3-+HS-
【解析】
(1)H2S的二级电离方程式为HS-S2-+H+,可求电离平衡常数表达式;
(2)25℃时,CH3COOH的电离平衡常数K=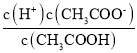 =10-5;
=10-5;
(3)(A)①CH3COONa,②Na2CO3,③Na2S,④NaHSO3,⑤Na2SO3溶液都是强碱弱酸盐,水溶液呈碱性,对应酸的酸性越弱,水解程度越大,溶液中氢氧根离子浓度越大,pH越大;
(B)纯碱的成分是碳酸钠,在水溶液中会发生水解:CO32- +H2O![]() HCO3-+ OH-;
HCO3-+ OH-;
(4)pH为5的硫酸溶液中氢离子浓度为:c(H+)=1×10-5mol/L,硫酸根离子的浓度为:c(SO42-)=0.5×1×10-5mol/L=5×10-6mol/L,溶液稀释1000倍后,氢离子浓度不可能小于1×10-7mol/L,只能无限接近1×10-7mol/L,而硫酸根离子浓度为:c(SO42-)=5×10-6mol/L×0.001=5×10-9mol/L,所以稀释后溶液中SO42-离子浓度与H+离子浓度的比值约为:5×10-9mol/L:1×10-7mol/L=1:2;pH 均为 5的醋酸溶液稀释 1000 倍,溶液的pH<7,不可能呈碱性,并且稀释后酸性肯定比原来的弱,pH>5,故pH 范围为5<pH<7;
(5)将少量H2S气体通入到 Na2CO3溶液会生成碳酸氢钠和硫氢化钠。
(1)H2S的二级电离方程式为HS-S2-+H+,则电离平衡常数表达式为Ka1=![]() ;
;
(2)25℃时,CH3COOH的电离平衡常数K=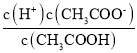 =10-5,
=10-5,![]() =0.1mol/L,设c(H+)=c(CH3COO-)=x,带入K中得
=0.1mol/L,设c(H+)=c(CH3COO-)=x,带入K中得![]() =10-5,解得x= c(H+)=0.001mol/L;由水电离的出的 c(H+)等于由水电离的出的 c(OH-),25℃时溶液中c(H+) c(OH-)=0.001mol/L c(OH-)=10-14,得水电离的出的c(OH-)=10-11mol/L;
=10-5,解得x= c(H+)=0.001mol/L;由水电离的出的 c(H+)等于由水电离的出的 c(OH-),25℃时溶液中c(H+) c(OH-)=0.001mol/L c(OH-)=10-14,得水电离的出的c(OH-)=10-11mol/L;
(3)(A)①CH3COONa,②Na2CO3,③Na2S,④NaHSO3,⑤Na2SO3溶液都是强碱弱酸盐,水溶液呈碱性,对应酸的酸性越弱,水解程度越大,溶液中氢氧根离子浓度越大,pH越大,由表可知对应酸的酸性大小为HS-<HCO3-<HSO3-<CH3COOH<H2SO3,pH由大到小排序为③②⑤①④;
(B)纯碱的成分是碳酸钠,在水溶液中会发生水解:CO32- +H2O![]() HCO3
HCO3
(4)pH为5的硫酸溶液中氢离子浓度为:c(H+)=1×10-5mol/L,硫酸根离子的浓度为:c(SO42-)=0.5×1×10-5mol/L=5×10-6mol/L;溶液稀释1000倍后,氢离子浓度不可能小于1×10-7mol/L,只能无限接近1×10-7mol/L,而硫酸根离子浓度为:c(SO42-)=5×10-6mol/L×0.001=5×10-9mol/L,所以稀释后溶液中SO42-离子浓度与H+离子浓度的比值约为:5×10-9mol/L:1×10-7mol/L=1:2;pH 均为 5的醋酸溶液稀释 1000 倍,溶液的pH<7,不可能呈碱性,并且稀释后酸性肯定比原来的弱,pH>5,故pH 范围为5<pH<7;
(5)将少量H2S气体通入到 Na2CO3溶液会生成碳酸氢钠和硫氢化钠,离子方程式为:H2S+CO32-===HCO3-+HS-;
(6)由电荷守恒可知c(H+)+c(NH4+)=2c(SO32-)+c(HSO3-)+c(OH-),

 阅读快车系列答案
阅读快车系列答案