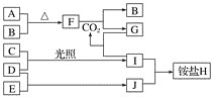
题目内容
【题目】用AG表示溶液的酸度,其表达式为AG=lg[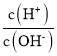 ],298K时,向10mL0.1 molL-1 HX溶液中滴加 0.1molL-1NaOH 溶液。溶液的AG与NaOH溶液体积的关系如图所示。下列说法错误的是 ( )
],298K时,向10mL0.1 molL-1 HX溶液中滴加 0.1molL-1NaOH 溶液。溶液的AG与NaOH溶液体积的关系如图所示。下列说法错误的是 ( )
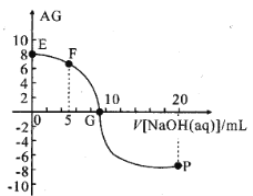
A.溶液pH和AG的关系式为AG=14-2pH
B.对G点溶液,c(Na+) = c(X-)
C.298K时HX的电离常数Ka≈1.0×10-5
D.溶液中水电离的c(OH-) F点<P点
【答案】D
【解析】
A、AG=lg[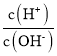 ]=lgc(H+)-lgc(OH-)=lgc(H+)-lg
]=lgc(H+)-lgc(OH-)=lgc(H+)-lg![]() ,结合pH=-lgc(H+)分析;
,结合pH=-lgc(H+)分析;
B、根据G点对应AG=0进行分析;
C、E点为HX溶液,Ag=8,c(H+)=1.0×10-3mol/L,结合HA的平衡常数Ka=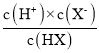 计算。
计算。
D、F点溶质为等浓度的NaX、HX,P点溶质为等浓度的NaX、NaOH,NaOH为强电解质,对水的抑制程度更大。
A、AG=lg[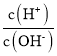 ]=lgc(H+)-lgc(OH-)=lgc(H+)-lg
]=lgc(H+)-lgc(OH-)=lgc(H+)-lg![]() =2pH-lgKW=14-2pH,故A不符合题意;
=2pH-lgKW=14-2pH,故A不符合题意;
B、G点对应AG=0,即lgc(H+)=lgc(OH-),溶液呈中性,根据电荷守恒可知,c(Na+) = c(X-),故B不符合题意;
C、E点为HX溶液,Ag=8,c(H+)=1.0×10-3mol/L,则HA的平衡常数K=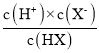 =
=![]() ≈1.0×10-5,故C不符合题意;
≈1.0×10-5,故C不符合题意;
D、F点加入5mL等浓度的NaOH溶液,反应后溶质为等浓度的NaX、HX,P点加入20mL等浓度的NaOH溶液,反应后溶质为等浓度的NaX、NaOH,NaOH为强电解质,对水的抑制程度更大,则P点水的电离程度小于F点水的电离程度,故D符合题意;
答案为D。

练习册系列答案
 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案
相关题目