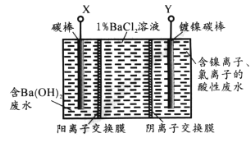
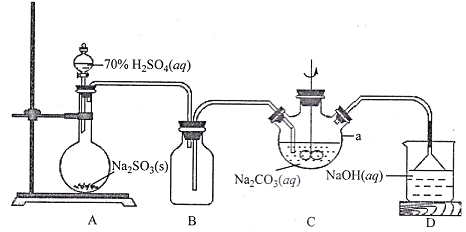
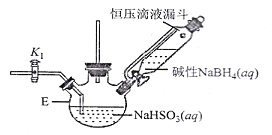
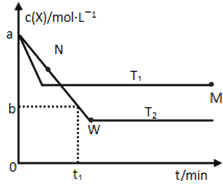
题目内容
【题目】已知X、Y、Z、W 是中学化学中常见的四种不同粒子,其中X、W 为分子,Y、Z为离子它们之间存在如下所示的转化关系:
X+Y→Z+W Z+H+ →X Y+H+ →W
(1)如果X、Y、Z、W 均是10电子的粒子,请写出:
X的电子式:____________; W 的电子式:_________________。
(2)如果X和Z均是18电子的粒子,Y 和 W 均是10电子的粒子,请写出:
①X与Y(足量)在溶液中反应的离子方程式:______________________。
②根据上述离子方程式,可判断Z与 Y 结合质子(H+ )的能力大小是 ________ >_____ 。(用化学式或离子符号表示)
【答案】![]()
![]() H2S+2OH— = S2— +2H2O OH— S2— (或HS—等合理答案均可)
H2S+2OH— = S2— +2H2O OH— S2— (或HS—等合理答案均可)
【解析】
(1)10电子微粒X、Y反应得到两种10电子微粒,X、W 为分子,Y、Z为离子,应是氟化氢与氢氧根离子反应得到氟离子与水,而Z、Y都能与氢离子反应,可推知X为HF,Y为OH,Z为F,W为H2O;
(2)如果X、Z均是18电子的粒子,Y、W是10电子粒子,X、W 为分子,Y、Z为离子,结合转化关系,可推断:X为H2S,Y为OH,Z为HS或S2,W为H2O。
(1)10电子微粒X、Y反应得到两种10电子微粒,X、W 为分子,Y、Z为离子,应是氟化氢与氢氧根离子反应得到氟离子与水,而Z、Y都能与氢离子反应,可推知X为HF,Y为OH,Z为F,W为H2O;HF的电子式为![]() ,H2O的电子式为
,H2O的电子式为![]() ;
;
(2)如果X、Z均是18电子的粒子,Y、W是10电子粒子,X、W 为分子,Y、Z为离子,结合转化关系,可推断:X为H2S,Y为OH,Z为HS或S2,W为H2O;X与Y(足量)在溶液中反应的离子方程式为:H2S+2OH— = S2— +2H2O,根据离子方程式,可以判断结合质子的能力大小是OH>S2或OH>HS。

 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案【题目】常温时,已知部分弱酸的电离平衡常数如下表:
弱酸 | CH3COOH | H2S | H2CO3 | H2SO3 |
电离平衡常数(25 ℃) | K=10-5 | K1=1.3×10 -7 K2=7.1×10 -15 | K1=4.4×10 -7 K2=4.7×10 -11 | K1=1.3×10 -2 K2=6.3×10 -8 |
请回答下列问题:
(1)H2S 的第二级电离平衡常数的表达式 K2=______
(2)25℃时,若 CH3COOH 的起始浓度为 0.1 mol·L -1,则平衡时 c(H+)=____mol/L,由水电离的出的 c(H+)=____mol/L。
(3)(A)相同浓度的①CH3COONa 溶液、②Na2CO3溶液、③Na2S溶液、④NaHSO3溶液和⑤Na2SO3溶液,pH 由大到小排序为________(用序号表示)
(B)纯碱可代替洗涤剂洗涤餐具,原因是(用离子方程式表示)___________
(4)pH 均为 5硫酸和醋酸两份溶液,把硫酸溶液稀释 1000 倍,则 c(H+)/c(SO42-)=___;把醋酸稀释 100 倍,pH 范围为_____
(5)将少量H2S气体通入到 Na2CO3溶液中发生反应的离子方程式为______
【题目】A、B、C、D、E是元素周期表前四周期中的常见元素,原子序数依次增大,相关信息如下:(NA为阿伏加德罗常数的值),请用化学用语回答下列问题:
元素 | 相关信息 |
A | 基态原子的价电子排布式为nSnnPn |
B | 元素原子的核外p电子数比s电子数少1个 |
C | 最外层电子数是电子层数的3倍 |
D | 简单离子是第三周期元素中离子半径最小的 |
E | 价电子层中的未成对电子数为4 |
(1)写出D元素在周期表的位置______,基态E2+价电子的排布图为_______,B元素能量最高的电子其轨道呈_______形。
(2)A与C形成的最高价化合物,中心原子轨道杂化类型为___________。
(3)A、B、C三种基态原子的第一电离能由大到小的顺序为_____________,B、C、D简单离子的半径由大到小的顺序为_________。
(4)写出C的核外有18个电子的氢化物的电子式________。
(5)E可用做某些反应的催化剂,CO易导致E失去催化活性:E+5CO = E(CO)5,E(CO)5熔点为-20℃,沸点为103℃,易溶于乙醚,其晶体类型为___________。
(6)已知沸点:B2H4>A2H6 ,主要原因为____________________。
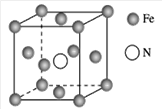
(7)铁的多种化合物均为磁性材料,氮化铁是其中一种,某氮化铁的晶胞结构如图所示,则氮化铁的化学式为________;设晶胞边长为a cm,该晶体的密度为________ g·cm-3(用含a和NA的式子表示)。
【题目】某学生欲用已知物质的量浓度的氢氧化钠来滴定测定未知物质的量浓度的盐酸溶液
(1)配制 500ml 浓度为 0.1 mol·L -1 的氢氧化钠溶液的操作步骤依次是:称量、____冷却并转移入容量瓶、洗涤并转___摇匀。
(2)用图中_____(填“甲”或“乙”)滴定管盛装 NaOH溶液。
![]()
(3)进行滴定操作时,该学生的实验步骤如下:
A.
B.用蒸馏水洗干净滴定管
C.碱式滴定管用标准液润洗后,将标准液注入碱式滴定管刻度“0”以上 2-3cm 处,再把碱式滴定管固定好,调节液面至刻度“0”或“0”刻度以下
D.用待测定的盐酸溶液润洗酸式滴定管
E.用酸式滴定管取待测HCl溶液25.00mL,注入锥形瓶中,加入2滴酚酞;
F.把锥形瓶放在滴定管下面,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度G.另取锥形瓶,再重复操作 2 次
上述步A的操作为____上述操作,如何判断滴定终点______
(4)下列操作中可能使所测盐酸溶液的浓度偏低的是_____
A.碱式滴定管未用标准氢氧化钠溶液润洗就直接注入标准液
B.滴定过程中,有液滴从锥形瓶中溅出
C.碱式滴定管在滴定前有气泡,滴定后气泡消失
D.读取氢氧化钠体积时,开始仰视读数,滴定结束时俯视读数
(5)某学生根据三次实验分别记录有关数据如下:请选用其中合理的数据计算该盐酸溶液的物质的量浓度:c(HCl) =_________
滴定次数 | 待测盐酸溶液的体积 /ml | 滴定前氢氧化钠的体积读数/ml | 滴定后氢氧化钠的体积读数/ml |
第一次 | 25.00 | 0.50 | 26.40 |
第二次 | 25.00 | 1.56 | 30.30 |
第三次 | 25.00 | 0.22 | 26.32 |