题目内容
【题目】SO2和NOx是主要大气污染物,利用下图装置可同时吸收SO2和NO。下列有关说法错误的是
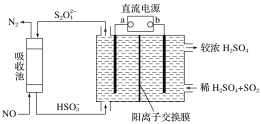
A.a极为直流电源的负极
B.阳极发生的反应式为SO2-2e-+2H2O=SO42-+4H+
C.阴极得到1mol电子时,通过阳离子交换膜的H+为2mol
D.吸收池中发生反应的离子方程式为:2NO+2S2O42-+2H2O=N2+4HSO3-
【答案】C
【解析】
A. 进去的是HSO3-,出来的是S2O42-,硫元素的化合价降低,发生还原反应,是阴极,与电源的负极相连,即a极为直流电源的负极,故A正确
B. 在阳极上发生失电子的氧化反应,故B正确;
C. 据电子守恒,则阴极得到电子量等于通过阳离子交换膜的H+的量,阴极得到1mol电子时,通过阳离子交换膜的H+为1mol,故C错误;
D、硫代硫酸根离子与一氧化氮发生氧化还原反应,生成氮气,离子反应方程式为:2NO+2S2O42-+2H2O=N2+4HSO3-,故D正确;
故选:C.

【题目】常温时,已知部分弱酸的电离平衡常数如下表:
弱酸 | CH3COOH | H2S | H2CO3 | H2SO3 |
电离平衡常数(25 ℃) | K=10-5 | K1=1.3×10 -7 K2=7.1×10 -15 | K1=4.4×10 -7 K2=4.7×10 -11 | K1=1.3×10 -2 K2=6.3×10 -8 |
请回答下列问题:
(1)H2S 的第二级电离平衡常数的表达式 K2=______
(2)25℃时,若 CH3COOH 的起始浓度为 0.1 mol·L -1,则平衡时 c(H+)=____mol/L,由水电离的出的 c(H+)=____mol/L。
(3)(A)相同浓度的①CH3COONa 溶液、②Na2CO3溶液、③Na2S溶液、④NaHSO3溶液和⑤Na2SO3溶液,pH 由大到小排序为________(用序号表示)
(B)纯碱可代替洗涤剂洗涤餐具,原因是(用离子方程式表示)___________
(4)pH 均为 5硫酸和醋酸两份溶液,把硫酸溶液稀释 1000 倍,则 c(H+)/c(SO42-)=___;把醋酸稀释 100 倍,pH 范围为_____
(5)将少量H2S气体通入到 Na2CO3溶液中发生反应的离子方程式为______