题目内容
【题目】为研究铁质材料与热浓硫酸的反应,某学习小组用碳素钢(即铁和碳的合金)进行了以下探究活动:
[探究一](1)将已去除表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移入硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是_____________________。
(2)称取碳素钢6.0 g放入15.0 mL浓硫酸中,加热,充分反应后得到溶液X并收集到混合气体Y。
①甲同学认为X中除Fe3+之外还可能含有Fe2+。若要确认其中的Fe2+,应选用_______(选填序号)。
A.KSCN溶液和氯水 B.铁粉和KSCN溶液C.浓氨水 D.酸性KMnO4溶液
②乙同学取560 mL(标准状况)气体Y通入足量溴水中,发生SO2+Br2+2H2O=2HBr+H2SO4反应,然后加入足量BaCl2溶液,经适当操作后得干燥固体4.66 g。由此推知气体Y中SO2的体积分数为_______。
[探究二]根据上述实验中SO2体积分数的分析,丙同学认为气体Y中还可能含有Q1和Q2两种气体,其中Q1气体,在标准状况下,密度为0.0893 g·L-1。为此设计了下列探究实验装置(假设有关气体完全反应)。
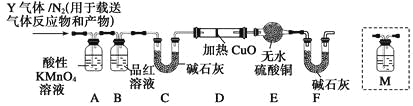
(3)装置B中试剂的作用是_______________________。
(4)分析Y气体中的Q2气体是如何生成的_____________(用化学方程式表示)。
(5)已知洗气瓶M中盛装澄清石灰水,为确认Q2的存在,需在装置中添加洗气瓶M于_______(填序号)。
A.A之前 B.A—B间
C.B—C间 D.C—D间
(6)如果气体Y中含有Q1,预计实验现象应是___________________。
【答案】铁被钝化了 D 0.80 检验SO2是否除尽 C+2H2SO4![]() CO2↑+2SO2↑+2H2O C D中的固体由黑变红和E中固体由白变蓝
CO2↑+2SO2↑+2H2O C D中的固体由黑变红和E中固体由白变蓝
【解析】
(1)常温下,铁遇冷的浓硫酸发生钝化现象;
(2)①亚铁离子有还原性,能还原酸性高锰酸钾溶液而使其褪色;
②气体Y通入足量溴水中,发生SO2+Br2+2H2O═2HBr+H2SO4反应,根据硫酸钡与二氧化硫的关系式计算二氧化硫的体积,再根据体积分数公式计算;
(3)二氧化硫能使品红溶液褪色;
(4)碳素钢中含有碳,加热条件下,碳和浓硫酸反应生成二氧化碳;
(5)用澄清石灰水检验二氧化碳,首先要排除二氧化硫的干扰;
(6)Q1气体,在标准状况下,密度为0.0893gL-1,其相对分子质量为2,所以是氢气,氢气检验还原性,能含有氧化铜同时生成水,水能使无水硫酸铜变蓝。
(1)由于在常温下,铁在浓硫酸中发生钝化,从而在铁表面形成一层致密的氧化膜,所以不再和硫酸铜溶液反应。
(2)①亚铁离子具有还原性,可以被酸性高锰酸钾溶液氧化,从而溶液褪色,据此可以鉴别,答案选D。
②硫酸钡的物质的量是0.02mol,则根据原子守恒可知,SO2的物质的量也是0.02mol。而混合气的物质的量是0.025mol,所以SO2的体积分数是![]() =0.80。
=0.80。
(3)在标准状况下,密度为0.0893g·L-1,则该气体的相对分子质量是0.0893×22.4=2.0,所以该气体是氢气。由于SO2也能把碱石灰吸收,所以A装置的作用是除去SO2,而B中品红溶液的作用就是检验SO2是否除尽的。
(4)由于浓硫酸的强氧化性,也能把碳氧化生成CO2,所以反应的方程式是C+2H2SO4![]() CO2↑+2SO2↑+2H2O;
CO2↑+2SO2↑+2H2O;
(5)由于CO2也能碱石灰吸收,所以要确认CO2的存在,则M应该放在B和C之间,答案选C。
(6)由于氢气具有还原性,能把氧化铜还原生成红色的铜和水,水能使无水硫酸铜变蓝,即实验现象是D中的固体由黑变红和E中固体由白变蓝。

【题目】常温时,已知部分弱酸的电离平衡常数如下表:
弱酸 | CH3COOH | H2S | H2CO3 | H2SO3 |
电离平衡常数(25 ℃) | K=10-5 | K1=1.3×10 -7 K2=7.1×10 -15 | K1=4.4×10 -7 K2=4.7×10 -11 | K1=1.3×10 -2 K2=6.3×10 -8 |
请回答下列问题:
(1)H2S 的第二级电离平衡常数的表达式 K2=______
(2)25℃时,若 CH3COOH 的起始浓度为 0.1 mol·L -1,则平衡时 c(H+)=____mol/L,由水电离的出的 c(H+)=____mol/L。
(3)(A)相同浓度的①CH3COONa 溶液、②Na2CO3溶液、③Na2S溶液、④NaHSO3溶液和⑤Na2SO3溶液,pH 由大到小排序为________(用序号表示)
(B)纯碱可代替洗涤剂洗涤餐具,原因是(用离子方程式表示)___________
(4)pH 均为 5硫酸和醋酸两份溶液,把硫酸溶液稀释 1000 倍,则 c(H+)/c(SO42-)=___;把醋酸稀释 100 倍,pH 范围为_____
(5)将少量H2S气体通入到 Na2CO3溶液中发生反应的离子方程式为______
【题目】某学生欲用已知物质的量浓度的氢氧化钠来滴定测定未知物质的量浓度的盐酸溶液
(1)配制 500ml 浓度为 0.1 mol·L -1 的氢氧化钠溶液的操作步骤依次是:称量、____冷却并转移入容量瓶、洗涤并转___摇匀。
(2)用图中_____(填“甲”或“乙”)滴定管盛装 NaOH溶液。
![]()
(3)进行滴定操作时,该学生的实验步骤如下:
A.
B.用蒸馏水洗干净滴定管
C.碱式滴定管用标准液润洗后,将标准液注入碱式滴定管刻度“0”以上 2-3cm 处,再把碱式滴定管固定好,调节液面至刻度“0”或“0”刻度以下
D.用待测定的盐酸溶液润洗酸式滴定管
E.用酸式滴定管取待测HCl溶液25.00mL,注入锥形瓶中,加入2滴酚酞;
F.把锥形瓶放在滴定管下面,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度G.另取锥形瓶,再重复操作 2 次
上述步A的操作为____上述操作,如何判断滴定终点______
(4)下列操作中可能使所测盐酸溶液的浓度偏低的是_____
A.碱式滴定管未用标准氢氧化钠溶液润洗就直接注入标准液
B.滴定过程中,有液滴从锥形瓶中溅出
C.碱式滴定管在滴定前有气泡,滴定后气泡消失
D.读取氢氧化钠体积时,开始仰视读数,滴定结束时俯视读数
(5)某学生根据三次实验分别记录有关数据如下:请选用其中合理的数据计算该盐酸溶液的物质的量浓度:c(HCl) =_________
滴定次数 | 待测盐酸溶液的体积 /ml | 滴定前氢氧化钠的体积读数/ml | 滴定后氢氧化钠的体积读数/ml |
第一次 | 25.00 | 0.50 | 26.40 |
第二次 | 25.00 | 1.56 | 30.30 |
第三次 | 25.00 | 0.22 | 26.32 |
