题目内容
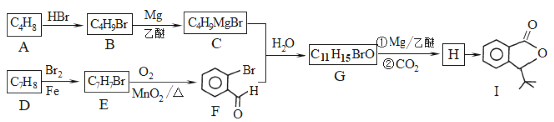
【题目】化合物I是一种抗脑缺血药物,合成路线如下:
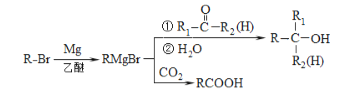
已知:
回答下列问题:
(1)按照系统命名法,A的名称是_____;写出A发生加聚反应的化学方程式:__________。
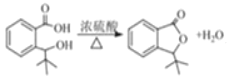
(2)反应H→I的化学方程式为________;反应E→F的反应类型是______。
(3)写出符合下列条件的G的所有同分异构体的结构简式:________
①遇FeCl3溶液发生显色反应 ②核磁共振氢谱有4组峰
(4)α,α-二甲基苄醇(![]() )是合成医药、农药的中间体,以苯和2-氯丙烷为起始原料制备α,α-二甲基苄醇的合成路线如下:
)是合成医药、农药的中间体,以苯和2-氯丙烷为起始原料制备α,α-二甲基苄醇的合成路线如下:
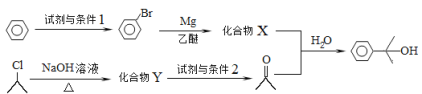
该合成路线中X的结构简式为____,Y的结构简式为________;试剂与条件2为______。
【答案】2-甲基丙烯 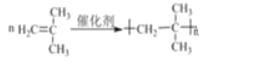
 氧化反应
氧化反应 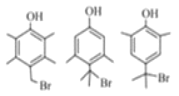
![]() (CH3 )2 CHOH O2、Cu 和加热
(CH3 )2 CHOH O2、Cu 和加热
【解析】
D发生取代反应生成E,E发生氧化反应生成F,由F结构简式知,D为甲苯、E为邻甲基溴苯![]() ;G发生信息中的反应生成H,H中应该含有一个-COOH,根据I结构简式知,H发生酯化反应生成I,则H为
;G发生信息中的反应生成H,H中应该含有一个-COOH,根据I结构简式知,H发生酯化反应生成I,则H为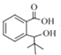 、G为
、G为![]() ;C、F发生信息中的反应生成G,则C为(CH3)3CBrMg,B为(CH3)3CBr,A中C、H原子个数之比为1:2,根据A、B分子式知,A和HBr发生加成反应生成B,A中含有一个碳碳双键,根据B知A为CH2=C(CH3)2据此分析。
;C、F发生信息中的反应生成G,则C为(CH3)3CBrMg,B为(CH3)3CBr,A中C、H原子个数之比为1:2,根据A、B分子式知,A和HBr发生加成反应生成B,A中含有一个碳碳双键,根据B知A为CH2=C(CH3)2据此分析。
D发生取代反应生成E,E发生氧化反应生成F,由F结构简式知,D为甲苯、E为邻甲基溴苯![]() ;G发生信息中的反应生成H,H中应该含有一个-COOH,根据I结构简式知,H发生酯化反应生成I,则H为
;G发生信息中的反应生成H,H中应该含有一个-COOH,根据I结构简式知,H发生酯化反应生成I,则H为 、G为
、G为![]() ;C、F发生信息中的反应生成G,则C为(CH3)3CBrMg,B为(CH3)3CBr,A中C、H原子个数之比为1:2,根据A、B分子式知,A和HBr发生加成反应生成B,A中含有一个碳碳双键,根据B知A为CH2=C(CH3)2。
;C、F发生信息中的反应生成G,则C为(CH3)3CBrMg,B为(CH3)3CBr,A中C、H原子个数之比为1:2,根据A、B分子式知,A和HBr发生加成反应生成B,A中含有一个碳碳双键,根据B知A为CH2=C(CH3)2。
(1)A为CH2=C(CH3)2,A的系统命名法命名的名称为2-甲基丙烯;A发生加聚反应生成2-甲基聚丙烯,反应的化学方程式为:![]() ;
;
(2)H为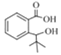 ,H发生酯化反应生成J,则H→I的反应方程为
,H发生酯化反应生成J,则H→I的反应方程为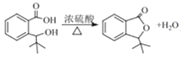 ;E→F是邻甲基溴苯发生氧化反应生成
;E→F是邻甲基溴苯发生氧化反应生成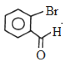 ,反应类型是氧化反应;
,反应类型是氧化反应;
(3)G为![]() ,G的同分异构体符合下列条件:①遇FeCl3溶液发生显色反应,说明含有酚羟基;②核磁共振氢谱有4组峰,说明分子中含有4种不同位置的氢原子,则符合条件的同分异构体有
,G的同分异构体符合下列条件:①遇FeCl3溶液发生显色反应,说明含有酚羟基;②核磁共振氢谱有4组峰,说明分子中含有4种不同位置的氢原子,则符合条件的同分异构体有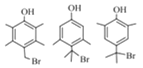 ;
;
(4)以苯和2-氯丙烷为起始原料制备a,a二甲基苄醇,苯和溴在催化条件下发生取代反应生成溴苯,溴苯发生信息中的反应生成X,2-氯丙烷发生水解反应生成2-丙醇,2-丙醇发生催化氧化生成丙酮,X和丙酮发生信息中的反应生成a,a二甲基苄醇。根据合成路线可知试剂与条件1为液溴、Fe作催化剂;X的结构简式为![]() ;Y的结构简式为(CH3)2CHOH;试剂与条件2为O2、Cu和加热。
;Y的结构简式为(CH3)2CHOH;试剂与条件2为O2、Cu和加热。

【题目】三硫代碳酸钠(Na2CS3)在农业上用作杀菌剂和杀线虫剂,在工业上用于处理废水中的重金属离子,某化学兴趣小组对Na2CS3的一些性质进行了探究性实验。
实验Ⅰ.探究Na2CS3的性质:
步骤 | 操作及现象 |
① | 取少量Na2CS3固体溶于蒸馏水中,配制成溶液并分成两等份 |
② | 向其中一份溶液中滴加几滴酚酞试剂,溶液变成红色 |
③ | 向另一份溶液中滴加用硫酸酸化的KMnO4溶液,紫色褪去 |
(1)H2CS3是___(填“强”或“弱”)酸。
(2)已知步骤③中反应的氧化产物是SO42-,则该反应的离子方程式为:____。
(3)某同学取步骤③反应后所得溶液于试管中,滴加足量盐酸和氯化钡溶液,他认为通过测定产生的白色沉淀的质量即可求出实验中所用的Na2CS3的质量。你是否同意他的观点,并说明理由:___。
实验Ⅱ.测定Na2CS3溶液的浓度:
按如图所示装置进行实验:将50.0mLNa2CS3溶液置于三颈烧瓶中,打开仪器M的活塞,滴入足量2.0mol·L-1的稀H2SO4,关闭活塞。
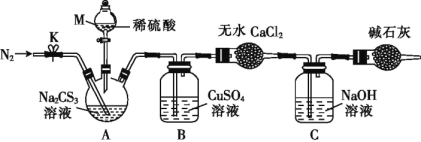
已知:CS32- +2H+=CS2+H2S↑,CS2和H2S均有毒。(CS2不溶于水,沸点为46℃,与CO2的某些性质相似,与NaOH作用生成Na2COS2和H2O)
(4)仪器M的名称是___。反应开始前需要先通入一段时间N2,其作用为____。
(5)B中发生反应的离子方程式为:____。
(6)为了计算三硫代碳酸钠溶液的浓度,可通过测定B中生成沉淀的质量来计算。称量B中沉淀质量之前需要进行的实验操作是___。若B中生成沉淀的质量为8.4g,则Na2CS3溶液的物质的量浓度是____。